корреляционные соотношения
КОРРЕЛЯЦИОННЫЕ СООТНОШЕНИЯ
характеризуют эмпирически устанавливаемые зависимости между разл. свойствами одного ряда хим. соед. (реакц. способностью, физ., термодинамич. св-ми, биол. активностью и др.) и параметрами структуры, среды или свойствами того же или др. ряда соединений. Формальный прототип большинства К. с. — уравнение Брёнстеда , выражающее найденную экспериментально линейную зависимость между константами скорости реакций kc кислотного (основного) катализа и константами равновесия диссоциации кислоты (основания) Ka:
lgke=algKa+c, (1)
где а и с — эмпирич. параметры для данной реакции. Уравнение (1) — пример выполнения общего соотношения линейности своб. энергий (ЛСЭ), согласно которому изменения в своб. энергиях реакций ΔG° и в своб. энергиях активации (ΔG++), вызываемые в разл. реакциях одинаковыми вариациями структуры реагирующих соед. или среды, связаны линейными зависимостями:
dRΔGi=adRΔGj+b, (2)
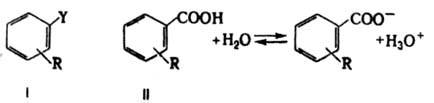
где dR — оператор изменения структуры (напр., при введении заместителя R) или среды, i, j — индексы реакций. Уравнение (2) отражает широкую эмпирич. закономерность: сходные изменения в строении соед. приводят к сходным изменениям в реакц. способности. Оно не вытекает из принципов термодинамики, поэтому К. с., основанные на соотношении ЛСЭ, принято относить к экстратермодинамическим. Важнейшее К. с. этого типа — уравнение Гаммета, сопоставляющее изменения в константах скорости или равновесия, индуцируемые введением заместителей в ароматич. бензольное ядро в соед. I, с изменениями в константах диссоциации бензойных кислот II при аналогичном замещении:
dRΔGi=аdRΔG0БK, (3)
где ΔGi — своб. энергии реакции или активации произвольной реакции соед. I в произвольных (но одинаковых для данной серии-,соед.) условиях, а ΔG0БК — своб. энергия диссоциации бензойной кислоты в заданных (не обязательно идентичных) условиях. Уравнение (3) сводится к виду:
lg(k/k0)=ρlg(K/K0)БК (4)
где k — константа скорости (равновесия) реакции соед. I с заместителем R, а k0 — та же константа для соед. с R=Н, К и K0 — константы диссоциации соответствующих бензойных кислот II, r — константа, характеризующая относительную (в сравнении с эталонной серией реакций диссоциации бензойных кислот) чувствительность реакций соед. I к структурным изменениям.
Реакц. серия диссоциации бензойных кислот в воде при 25 °C выбрана как стандартная, при этом величины lg(K/K0)=s представляют константы заместителей R. Уравнение (4) известно как уравнение Гаммета и обычно записывается в форме:
lgk=rs+lgk0 (5)
Уравнение (5) позволяет с точностью b15% рассчитывать кинетич. и равновесные параметры мн. реакций производных бензола с мета- и пaра-заместителями, располагая константами заместителей и величинами ρ, определенными статистически достоверно для неск. соед. данной реакц. серии. К. с. для структурных вариаций субстрата. В табл. приведены значения констант заместителей σ для некоторых наиб. важных групп (σм и σn — константы заместителей в мета- и пара-положениях). Для реакций, ускоряемых электронодонорными заместителями (σ<0), ρ<0, для реакций, ускоряемых электроноакцепторными заместителями
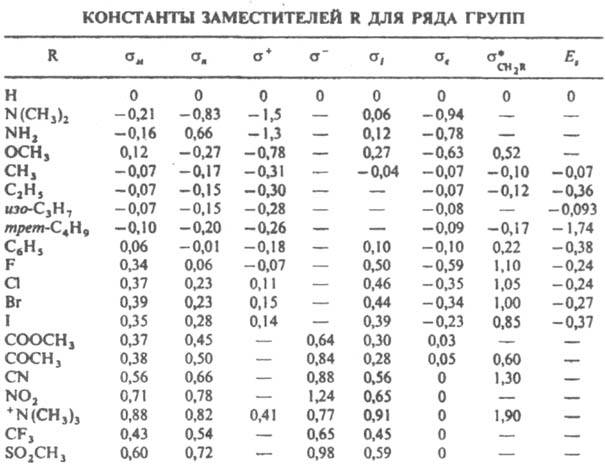
(σ>0), ρ>0. Абс. величина ρ тем больше, чем более полярно переходное состояние лимитирующей стадии реакции. Например, для нитрования соед. I (Y=Н) в ацетоне при 25 °C ρ=-7,3, для замещения Y=F в соед. I на метоксигруппу под действием CH3ONa ρ=+7,55, для этерификации бензойных кислот II метиловым спиртом ρ=-0,58. Рассчитанные по данным о константах диссоциации бензойных кислот II значения а для заместителей, способных к сопряжению с реакц. центрами Y в соединениях I, оказываются заниженными по абс. величине. Такие заместители, как NO2, CHO, COOCH3, взаимодействующие с сильными нуклеоф. группами Y=ОН, О−, CH2−, NH2 и др., или электронодонорные заместители OH, О−, NH2, SR, взаимодействующие с электроф. реакц. центрами Y=COR, NO2, С+ и др., характеризуются соотв. нуклеоф. s − и электроф. s+ константами, вычисляемыми на основе подходящих реакц. серий. Применение констант s − и s+ позволяет сохранить форму К. с. (5). Более точные корреляции достигаются при переходе к многопараметровым уравнениям, в которые включаются константы заместителей, характеризующие отдельно индуктивное, мезомерное и стерич. влияние заместителей. Если оставить в реакц. серии соед. II в качестве заместителей только группы, своб. от сопряжения с реакц. центром (OCH3, F, Cl, Br, I, COCH3), можно получить ряд констант σ°, значения которых учитывают индукц. эффект заместителя в бензольном кольце и индуцируемую поляризацию π-электронов кольца. Посредством подбора подходящих модельных соед. (напр., 4-замещенных бицикло [2,2,2] октан-1-карбоновых кислот) можно, пользуясь соотношением типа (5), получить константы, описывающие только индукц. влияние σI, и выделить мезомерные константы заместителей σс и s0c:
σс=σn-σI s0c=s0n-σI,
где s0n — константа заместителя в пара-положении. Корреляц. четырехпараметровые уравнения:
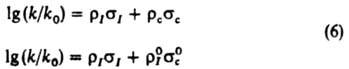
позволяют раздельно оценивать вклады индукц. и мезомерных эффектов заместителей в относит. реакц. способность. Известны другие К. с. [Юкава-Цуно, Дьюара — Грисдейла, Свена(Свейна) — Лаптона], в которых применяются др. подходы к разделению общего эффекта заместителя на его составляющие. Рассмотренные константы заместителей характеристичны для производных бензола I. Развиты К. с. для характеристики реакц. способности др. типов соед. — полиядерных ароматич., гетероциклич., олефинов и алифатич. соединений. В последнем случае применяют уравнение Тафта [σ* — константа Тафта, k и kCH3 — константы скорости или равновесия реакций алифатич. соед. соотв. RY и CH3Y, ρ* — параметр, аналогичный ρ в уравнении (4)]:

и для соед. с неск. заместителями:
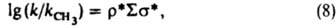
причем σ* линейно связаны с константами σI:
σ*(R)=6,23σI(R) σI(R)=0,45σ*(CH2R)
Для учета влияния пространств. эффектов заместителей на реакционная способность алифатич. соед. вводятся стерич. константы заместителей Es, определяемые по данным о скоростях кислотного гидролиза сложных эфиров: Es=lg(k/k0), где k иk0 — константы скорости соотв. для. соед. с заместителем R в ацильной компоненте и для ацетата. Константы Es определяются объемом заместителей и линейно зависят от их ван-дер-ваальсовых радиусов. Совместный учет влияния электронных и пространств. факторов на реакционная способность алифатич. соед. осуществляется при помощи уравнения:
lg(k/k0)=ρ*σ*+ρsEs, (9) где ρs — параметр, аналогичный по смыслу ρ в уравнении (4).
К. с. для вариации реагентов применяют для количеств, описания реакций с варьируемым реагентом при постоянном субстрате. Для бимолекулярного нуклеоф. замещения выполняется уравнение Свена — Скотта: lg(k/k0)=s∙n. (10) где k и k0 — константы скорости реакции субстрата соотв. с данным нуклеофилом и с водой, параметр s характеризует чувствительность реакции к варьированию реагента (селективность), константы n определяются по данным о кинетике реакций стандартного субстрата — CH3Br с рядом нуклеофилов и зависят от условий проведения реакции (среды, температуры). Для водных растворов при 0 °C значения n для некоторых нуклеофилов равны 6,35 (для S2O32−, 5,13 (CN−), 4,16 (NH3), 2,99 (Cl−), 1,88 (F−), 0 (H2O). Для реакций стабильных орг. катионов и активир. карбонильных соед. с нуклеофилами хорошая корреляция достигается при помощи уравнения Ритчи: lgk=N++C, (11) где С — константа, характерная для субстрата [напр., С=-5 для трис-(n-диметиламинофенил)метильного катиона и С — 1 для n-нитрофенилдиазония], значение N+ — функции среды и температуры. Так, N+=13,1 для нуклеофила C6H5S− в диметилсульфоксиде, а в CH3OH составляет 10,7. Отсутствие в уравнении (11) константы чувствительности реакции означает, что два субстрата (1 и 2) имеют одинаковую селективность по отношению к одному и тому же нуклеофилу: lg(k1/k2)=C1-C2. Известен целый ряд многопараметровых К. с. для учета влияния варьируемого реагента на реакц. способность. К. с. для характеристики влияния растворителя на реакц. способность. Соотношения ЛСЭ выполняются для характеристики влияния варьирования растворителя на скорость или константы равновесия заданной реакции. Для корреляции скоростей сольволиза используют уравнение Грюнвальда — Уинстейна: lg(k/k0)=m∙Y, (12) где т — константа чувствительности, аналогичная реакц. константе ρ в уравнениях (4)-(9), а Y-параметр полярности растворителя. В качестве стандартной серии (т =I) выбран сольволиз трет-C4H9Cl в 80%-ном этаноле. Применимость уравнения (12) ограничивается сольволизом в достаточно высокополярных растворителях (Y=0 для 80%-ного этанола, −0,60 для формамида, −3,26 для трет-бутанола, 3,49 для воды). Для более широкого круга реакций применяют многопараметровые К. с., включающие параметры растворителей, рассчитанные на основе спектральных данных (смещения длинноволновых полос поглощения полярных соед. в разл. растворителях), — параметры Димрота FT, константы Косовера Z, константы Тафта -Камле π*. В основе К. с. для физ. характеристик лежит установленная квантовомех. расчетами линейная зависимость констант заместителей а от величин электронных зарядов, индуцируемых заместителем на реакц. центре и прилегающих атомах, и др. характеристик электронного распределения в молекулах и ионах. Известны разнообразные К. с., связывающие дипольные моменты, частоты и интенсивности полос в колебат. спектрах, хим. сдвиги ядер в спектрах ЯМР и пр. от разл. типов электронных и стерич. констант заместителей. Например, для хим. сдвигов 19F в спектрах ЯМР мета-(Fм) и пара-замещенных (Fn) бензолов с хорошей точностью выполняются К. с.:
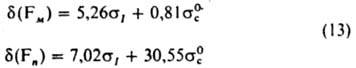
Для интенсивностей колебаний кольца производных бензола в области 1600 и 1585 см−1, характеризующих искажения π-электронной системы кольца, выполняется К. с.:
(А-100)1/2= 132,7σc°, (14)
где А — интегральная интенсивность полосы поглощения в ИК спектре. Соотношения (13), (14) используют для вычисления констант заместителей σI, σ°c, σ°. К. с. в биохимии становятся важным средством предсказания и целенаправленного поиска структурных модификаций, способствующих повышению биол. активности, в сериях соед. с систематич. варьируемыми структурными признаками. Важный параметр, связываемый с библ. активностью, — коэф. распределения Р в бинарной системе углеводород-вода. Значения Р определены для более чем 10000 соединений. Общая модель К. с. типа "структура — активность" строится на изучении зависимостей (15)-(17). Скорость биол. ответа = B∙C∙k. (15) где С — количество введенного в организм препарата, В — фактор, характеризующий вероятность достижения препаратом рецептора за определенный промежуток времени, k — константа скорости или равновесия лимитирующей стадии реакции, ведущей к контролируемому биол. ответу. Уравнениe (15) сводится к К. с.: lg(1/C)=a(lgP)2+b(lgP)+clgk+d, (16) где a, b, с, d — коэф., получаемые в результате статистич. обработки данных эксперимента. Для мн. биол. систем для констант k выполняется К. с.:
lgk=aπ+bv+cEs+d (17)
где π=lg(P/PH), Рн — коэф. распределения для соед. с заместителем Н. Уравнения типа (15)-(17) — важные элементы системного анализа биол. активности орг. и прир. соединений.
Лит.: Жданов Ю. А., Минкин В. И., Корреляционный анализ в органической химии. Ростов н/Д., 1966; Пальм В. А., Основы количественной теории органических реакций. Л., 1967; Джонсон К., Уравнения Гаммета, пер. с англ., М.. 1977; Advances in linear free energy relationships, ed. by N. B. Chapman. J. Shorter. N.Y.-L, 1972; Correlation analysis in chemistry. Recent advances, ed. by N.B. Chapman, J. Shorter, N. Y.-L, 1978; Hansch C, Leo A., Substituent constants for correlation analysis in chemistry and biology, N. Y., 1979; Klumpp G. W., Reactivity in organic chemistry, N. Y., 1982.
В. И. Минкин
