фтор
ФТОР (от греч. phthoros — разрушение; лат. Fluorum) F
хим. элемент VII гр. периодической системы, относится к галогенам; ат. н. 9, ат. м. 18,998403. Прир. Ф. состоит из одного стабильного нуклида 19F. Поперечное сечение захвата тепловых нейтронов 1∙10−31 м2. Конфигурация внеш. электронной оболочки атома 2s22p5 степень окисления -1; энергии ионизации при последоват. переходе от F0 к P7+ соотв. равны 1681, 3375, 6046, 8409, 11024, 15164 и 17868 кДж/моль; сродство к электрону 327,8 кДж/моль. Ф. — самый электроотрицат. элемент, его электроотрицательность по Полингу 3,98. Ионный радиус F (в скобках даны координац. числа): 0,115 нм (2), 0,116 нм (3), 0,117 нм (4) и 0,119 нм (6). Ядро атома 19F имеет спин 1/2 и близкое к свойственному для протия гиромагн. отношение, что позволяет получать спектры ЯМР с высоким разрешением.
Молекула своб. Ф. двухатомна, межатомное расстояние 0,14165 нм. F2 имеет аномально низкую (по сравнению с ожидаемой) в ряду галогенов энергию диссоциации (158 кДж/моль).
Содержание Ф. в земной коре 0,065% по массе. Встречается только в связанном состоянии. Осн. минерал, имеющий пром. значение,- флюорит (плавиковый шпат) CaF2, месторождения которого встречаются на всех континентах, а наиб. запасы сосредоточены в США, Мексике, Великобритании, Италии, ЮАР, Таиланде, Монголии, КНР. Общее содержание Ф. в пром. рудах CaF2 122, в перспективных — 236 млн. т (1984, без СССР). В СНГ залежи флюорита имеются в Узбекистане, Таджикистане, Казахстане, в Забайкалье, Приморском крае и др.
К редким фторсодержащим минералам относятся криолит Na3AlF6, хиолит 5NaF∙3AlF3, селлаит MgF2, иттрофлюорит Ca1-xYxF2-x. Изоморфно замещая ионы OH−, О2− и др., Ф. входит также в состав мн. минералов, напр. топаза Al2SiO4(OH, F)2, амблигонита LiAlPO4(OH, F), бастнезита (Ce, La)CO3F, апатита Ca5(PO4)3(OH, F), слюд и гидросиликатов. Наиб. пром. значение помимо флюоритовых руд имеют апатит и фосфориты, из которых Ф. получают в виде хим. соед.; они содержат не более 3,5–4,2% Ф. по массе, но добываются в больших количествах для производства соед. фосфора. Запасы Ф. в фосфатных рудах СНГ в 5 раз превышают его запасы во флюоритовых рудах (1988). Соед. Ф. содержатся во мн. подземных водах.
В небольших количествах Ф. входит в состав живых организмов (в организме человека 2,6 г Ф., из них 2,5 г — в костях), участвует в процессах образования зубов и костей, в обмене веществ и в активации некоторых ферментов. Нормальное поступление Ф. в организм человека 2,5–3,5 мг в сут. Пониженные и повышенные количества Ф. вызывают разл. заболевания.
Свойства. Ф. — бесцветный газ с сильным запахом, напоминающим запах хлора; т. кип. −188,20 °C, т. пл. −219,70 °C; плотн. газа 1,693 кг/м3 (О °C, 0,1 МПа), жидкости 1516 кг/м3 ( −188 °C); .tкрит −128,84 °C, pкрит 5,215 МПа, dкрит 0,574 г/см3; давление в тройной точке 252 Па; 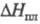 0,5104 кДж/моль,
0,5104 кДж/моль,  6,544 кДж/моль; C0p 31,34 Дж/(моль∙К);
6,544 кДж/моль; C0p 31,34 Дж/(моль∙К); 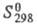 202,68 Дж/(моль∙ К); теплопроводность газообразного Ф. с точностью до 10% совпадает с теплопроводностью N2; коэф. самодиффузии при 0 °C и атм. давлении 0,170 см2/с.
202,68 Дж/(моль∙ К); теплопроводность газообразного Ф. с точностью до 10% совпадает с теплопроводностью N2; коэф. самодиффузии при 0 °C и атм. давлении 0,170 см2/с.
В твердом состоянии при обычном давлении Ф. образует две кристаллич. модификации: ниже −227,60 °C 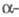 форму с моноклинной решеткой (плотн. 1,97 г/см3 при −250 С), выше —
форму с моноклинной решеткой (плотн. 1,97 г/см3 при −250 С), выше — 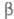 -форму с кубич. решеткой (а = 0,667 нм, плотн. 1,70 г/см3).
-форму с кубич. решеткой (а = 0,667 нм, плотн. 1,70 г/см3).
Плотн. жидкого Ф. описывается уравнением d= 1,907–2,20- 10−3T-2,948∙10−5T2 г/см3 (67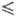 T
T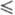 103 К); вязкость — уравнением
103 К); вязкость — уравнением 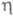 = 2,43∙10−7ехр( 196/T)Па ∙с; уравнение температурной зависимости давления пара над жидким Ф. 1n(р/ртрПа) = 7,89592346Х+3,38765063Х2 — 1,34590196X3 + 2,71138936X(1-X)1,4327, где X = (1 — Ттр/T)/(1 — Ттр/Ткрит; Tтр и pтр — соотв. температура и давление в тройной точке; Ткрит -критич. температура; γ жидкого Ф. 0,0179 Н/м (69,2 К) и 0,0146 Н/м (81,0 К);
= 2,43∙10−7ехр( 196/T)Па ∙с; уравнение температурной зависимости давления пара над жидким Ф. 1n(р/ртрПа) = 7,89592346Х+3,38765063Х2 — 1,34590196X3 + 2,71138936X(1-X)1,4327, где X = (1 — Ттр/T)/(1 — Ттр/Ткрит; Tтр и pтр — соотв. температура и давление в тройной точке; Ткрит -критич. температура; γ жидкого Ф. 0,0179 Н/м (69,2 К) и 0,0146 Н/м (81,0 К); 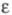 1,4577 (70,0 К) и 1,2073 (143,0 К).
1,4577 (70,0 К) и 1,2073 (143,0 К).
Ф. раств. в некоторых фторидах, хлор- и фторуглеродах. Жидкий Ф. неограниченно смешивается с жидкими O2 и O3. С водой энергично реагирует: 2F2 + 2H2O 4HF + O2. Не образует кислородных кислот, с H2 бурно реагирует, давая фтористый водород. Для орг. соед. известны фторноватистой кислоты эфиры.
4HF + O2. Не образует кислородных кислот, с H2 бурно реагирует, давая фтористый водород. Для орг. соед. известны фторноватистой кислоты эфиры.
Ф. — один из сильнейших окислителей и фторирующих реагентов. Благодаря высокой энергии связи элемент — фтор во фторидах и низкой энергии диссоциации F2 многие реакции фторирования простых веществ, оксидов, галогенидов и др. соед. необратимы, сопровождаются выделением большого количества тепла и образованием фторидов элементов в высш. степенях окисления. Все хим. элементы, за исключением Не, Ne и Ar, образуют устойчивые фториды.
В то же время по кинетике взаимод. с Ф. поведение веществ может сильно отличаться. Многие реакции имеют цепной характер, самопроизвольно инициируются при комнатной или более низкой температуре и протекают со вспышкой или со взрывом, а в потоке — с возникновением пламени. К таким реакциям относится фторирование H2 и водородсодержащих веществ (углеводородов, H2O, NH3, N2H4, HCl, HBr, HCN и др.), S и ее производных (SO2, SOCl2, S4N4, SBr2 и др.), Si, P и др. Теоретич. температура горения стехиометрич. смеси с H2 4430 К. При комнатной температуре с Ф. способны реагировать щелочные металлы, некоторые галогениды, гидраты солей. В то же время реакции F2 с большей частью простых веществ и неорг. соед. протекают лишь при их активации, достигаемой обычно повышением температуры или давления. На величину температуры начала фторирования влияют природа веществ, дисперсность твердых веществ, свойства продуктов реакции (нелетучие фториды могут экранировать поверхность, замедлять и даже прекращать фторирование), условия процесса (парциальное давление F2, интенсивность теплоотвода и др.). Реакция F2 с Ag, V, Re, Os начинается при 100–250 °C, с Au, Cd, Ti, Zr, Nb, Ta, Cr, W, Mn, Со — при 300–350 °C, а с Al, Fe, Cu, Zn, Y, Ni (на поверхности которых образуется пленка нелетучих фторидов) — лишь ок. 400–500 °C. Температурный интервал "спокойного", регулируемого фторирования, однако, невелик, и при избытке F2 многие реакции переходят при превышении некоторой температуры в горение. Особое место занимает фторирование графита, сопровождающееся образованием при температурах ниже 400 °C фторидов графита CFx (см. графита соединения).
Оксиды металлов и многие соли неск. более устойчивы к действию F2, чем сами металлы. Взаимод. оксидов может сопровождаться образованием на промежут. стадиях окси-фторидов.
Наиб. устойчивы к действию F2 благородные газы, N2, O2, алмаз, некоторые виды стеклоуглерода, CO, CO2, сапфир и алунд.
Одним из путей снижения температуры фторирования является применение катализаторов. Активация F2 м. б. проведена также его атомизацией и ионизацией в газовых разрядах, электронном пучке, под действием УФ облучения и термокаталитически (на нагретой поверхности катализатора). Атомный F при комнатной температуре и в криогенных условиях взаимод. с Xe,
Kr, CO, NOF, NO2, O2, ClF3 и мн. др. веществами.
• см. также фторирование
Наиб. важным соед. Ф. посвящены отдельные статьи: Азота фториды, Бора трифторид, Галогенфториды, Кислорода фториды, Кремния фториды, Фтористоводородная кислота, Фтористый водород, Фторобораты, Фторорганические соединения, Фторосиликаты и др.
Получение. Общая схема производства своб. Ф. включает добычу и обогащение флюоритовых руд, серно-кислотное разложение флюоритовых концентратов, выделение и очистку безводного HF, его электролитич. разложение. Ведущие производители флюоритовых концентратов — Мексика (20–25% мирового производства), ЮАР, Монголия, КНР, Таиланд, Франция, Испания. Общий мировой объем их производства 4–5 млн. т в год.
Электролитич. разложение HF м. б. осуществлено 3 способами: низкотемпературным (15–50 °C, в смеси HF с KF), среднетемпературным (70–120 °C, расплав KH2F3) и высокотемпературным (245–310 °C, расплав KHF2). В промышленности используют среднетемпературный способ. Стандартный потенциал разложения HF в расплаве KH2F3 равен 2,9 В. Пром. электролизеры работают обычно при 80–105 °C, напряжении 8,5–12,0 В и анодной плотности тока 70–180 мА/см2. Их мощность по току достигает 11 кА, опытных образцов −15 кА, что соответствует производительности 7–10 кг P2/ч.
Электролизеры представляют собой стальные или монеле-вые ванны с размещенными на крышке угольными анодами и расположенными между анодами стальными катодами. В некоторых конструкциях между катодами и анодами имеются перфорированные диафрагмы, предотвращающие смешивание и взаимод. выделяющихся F2 и H2. Совр. электролизеры снабжены системами непрерывной подачи в них HF, поддержания постоянной температуры, отвода H2 и F2. Отбор F2 проводят с помощью спец. коробчатых сборников, "колоколов", расположенных на крышке и погруженных в расплав так, что они окружают верх. часть анодов. При электролизе на поверхности угольных анодов образуется пассивирующий слой фторидов графита CFx, что вызывает "анодный эффект" — резкое повышение напряжения и его скачки. Этот эффект подавляют введением в электролит добавок, использованием анодов особой конструкции и пульсирующего тока. Свежезагружаемый электролит тщательно обезвоживают, проводя электролиз примеси влаги при низком напряжении. Для снижения температуры процесса разрабатывают электролиз смеси KH2F3 — NH4HF2 — HF.
Очищают Ф. методами селективной сорбции примесей (HF на гранулированном пористом NaF), вымораживания примесей, сжижения Ф., хим. и фотохим. связывания примесей. Глубокую очистку Ф. проводят с помощью низкотемпературной ректификации или его обратимой хемосорбцией (напр., путем образования и термич. разложения K2NiF4).
Для получения своб. Ф. в лабораториях или в портативных установках могут использоваться его твердые источники. Так, MnF4 при нагр. до 200 °C выделяет ок. 15% F2 от своей начальной массы. Взаимод. K2MnF6 и SbF5 протекает с выделением KSbF6, MnF3 и F2. Разработаны пиротехн. источники F2, содержащие соли тетрафтораммония.
Определение. Осн. метод определения Ф. в растворах — потен-циометрия с использованием спец. селективных электродов. Чувствит. элемент таких электродов (мембрану) чаще всего изготовляют из монокристаллич. LaF3, легированного дифто-ридами др. металлов. Кроме того, применяют гравиметрич. или объемный методы, основанные на осаждении труднорастворимых PbClF, CaF2, ThF4 и др.
Наиб. универсальный метод разложения мн. твердых неорг. фторидов — пирогидролиз. Образующийся HF поглощают водными растворами и анализируют объемным или потенциометрич. методами. Применяют также отгонку с парами H2O и улавливание в виде H2SiF6, разл. физ. методы.
Свободный Ф. в газах определяют потенциометрически, поглощением его твердым NaCl и последующим определением выделившегося Cl2 иодометрически, поглощением его ртутью и волюмометрич. определением. Фторорг. вещества предварительно разлагают натрием. Качественно Ф. обнаруживают по вьщелению HF, а также методами количеств, анализа.
Применение. Своб. Ф- фторирующий реагент в производстве UF6 (см. урана фториды), галогенфторидов, SF4, SF6, BF3, фторидов азота, фторидов графита, высш. фторидов металлов (WF6, MoF6, ReF6), фторидов благородных газов, фторорг. производных и др. Атомный Ф. используют в хим. лазерах на HF и DF, для синтеза KrF2, кислорода фторидов и др.
Ф. сильно токсичен. Раздражает кожу, слизистые оболочки носа и глаз; непереносимая концентрация 77 мг/м3. Вызывает дерматиты, конъюнктивиты, отек легких. Контакт с чистым Ф. приводит к ожогу. Хронич. отравление соед. Ф. вызывает флюороз. ПДК 0,03 мг/м3 — в воздухе производств. помещений, 0,7 мг/л — в воде (для фторид-иона).
Сжиженный Ф. перевозят в охлаждаемых цистернах и хранят в танках.
Мощности по производству своб. Ф. в развитых странах достигают 15–20 тыс. т в год.
Ф. открыт К. Шееле в 1771, в свободном виде получен А. Муассаном в 1886.
Лит.: Раков Э.Г., Химия и технологах неорганических фторидов, М., 1990; Gmelins handbook of inorganic chemistry, system. № 5. F. Fluorine. Suppl. v. 2. The element, B., 1980.
Э. Г. Раков
Значения в других словарях
- Фтор — (лат. Fluorum) F, химический элемент VII группы периодической системы Менделеева, относится к галогенам (См. Галогены), атомный номер 9, атомная масса 18,998403; при нормальных условиях (0 °С; 0,1 Мн/м2... Большая советская энциклопедия
- фтор — -а, м. Бледно-желтый газ с резким запахом, самый активный из неметаллов, разрушающе действующий на многие вещества. [От греч. φθόρος — гибель, разрушение] Малый академический словарь
- фтор — орф. фтор, -а Орфографический словарь Лопатина
- фтор — Фтор/. Морфемно-орфографический словарь
- ФТОР — ФТОР (символ F), газообразный токсичный элемент группы ГАЛОГЕНОВ (элементы VII группы периодической таблицы), впервые выделенный в 1886 г. Его основными источниками являются флюорит и криолит. Научно-технический словарь
- Фтор — (Ftuorum; F) химический элемент VII группы периодической системы Д.И. Менделеева, атомный номер 9, атомный вес (масса) 18,998; относится к галогенам; бледно-желтый газ с резким запахом; соединения Ф. содержатся в тканях организма, главным. образом в костях и зубной эмали. Медицинская энциклопедия
- Фтор — F (от греч. phthoros — гибель, разрушение, лат. Fluorum * a. fluorine; н. Fluor; ф. fluor; и. fluor), — хим. элемент VII группы периодич. системы Mенделеева, относится к галогенам, ат. н. 9, ат. м. 18,998403. B природе 1 стабильный изотоп 19F. Горная энциклопедия
- фтор — ФТОР, а, м. Химический элемент, ядовитый бесцветный газ с едким запахом. | прил. фтористый, ая, ое. Толковый словарь Ожегова
- фтор — ФТОР, фтора, ·муж. (·греч. phthoros — гибель) (·хим. ). Химический элемент, бесцветный газ с едким запахом. Толковый словарь Ушакова
- фтор — ФТОР -а; м. [от греч. phthoros — гибель, разрушение] Химический элемент (F), светло-жёлтый газ с едким запахом. Добавлять в питьевую воду ф. Толковый словарь Кузнецова
- фтор — ФТОР, см. флюор. Толковый словарь Даля
- Фтор — (хим. обозначение F, частица F2, атомный вес — 19,05). Ф. — химический элемент, составляющий вместе с хлором, бромом и йодом одну особую характерную группу тел, так называемую группу галоидов. Свое название... Энциклопедический словарь Брокгауза и Ефрона
- фтор — Фтора, м. [греч. phthoros – гибель] (хим.). Химический элемент, бесцветный газ с едким запахом. Большой словарь иностранных слов
- ФТОР — ФТОР (лат. Fluorum) — F, химический элемент VII группы периодической системы Менделеева, атомный номер 9, атомная масса 18,998403, относится к галогенам. Бледно-желтый газ с резким запахом, tпл ?219,699 °С, tкип ?188,200 °С, плотность 1,70 г/см3. Большой энциклопедический словарь
- фтор — фтор м. Химический элемент, светло-жёлтый ядовитый газ с едким запахом. Толковый словарь Ефремовой
