тиофен
ТИОФЕН
мол. м. 84,14; бесцветная жидкость с запахом бензола; т. пл. −38,2 °C, т. кип. 84,2 °C; 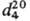 1,0649,
1,0649, 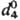 1,0873;
1,0873; 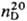 1,5289; tкрит 307,2 °C; tкрит 5,69 МПа; μ 1,766∙10−30 Кл∙м; Сp 63,8 Дж/(моль∙К);
1,5289; tкрит 307,2 °C; tкрит 5,69 МПа; μ 1,766∙10−30 Кл∙м; Сp 63,8 Дж/(моль∙К); 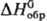 −82,13 кДж/моль, ΔHисп 33,483 кДж/моль,
−82,13 кДж/моль, ΔHисп 33,483 кДж/моль, 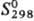 277 Дж/(моль∙К).
277 Дж/(моль∙К).
Хорошо раств. в углеводородах и др. органических растворителях, не раств. в воде. Молекула Т. плоская.
Гомологи Т. — бесцв. жидкости, растворимые во мн. органических растворителях. Для 2-метилтиофена т. пл. −63,5 °C, т. кип. 112,2 °C, 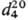 1,0194,
1,0194, 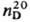 1,5203; для 3-метилтиофена соотв. −68,9 °C, 115,4 °C, 1,0216 и 1,5204.
1,5203; для 3-метилтиофена соотв. −68,9 °C, 115,4 °C, 1,0216 и 1,5204.
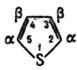
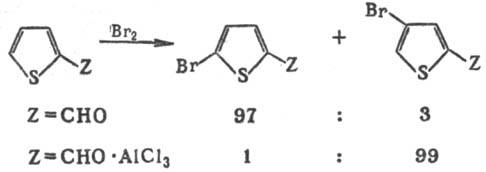
Т. относится к π-избыточным гетероароматич. системам и обладает выраженными ароматич. свойствами. В реакциях электроф. замещения (галогенирование, нитрование, формилирование, дейтерирование и др.) Т. значительно активнее бензола (в некоторых случаях в 100000 раз). Реакции идут обычно (иногда исключительно) в α-положение цикла (на 2–3 порядка быстрее, чем в др. положение). Для производных Т., содержащих в положении 2 ориентанты II рода, реакции идут с образованием 2,5-дизамещенных. 2,4-Изомеры получают, вводя в реакции исходные соед. в виде комплексов с сильными протонными или апротонными кислотами, что объясняется резким увеличением электроноакцепторной способности заместителя в результате комплексообразования:
Т. и его производные менее стабильны, чем их бензольные аналоги, поэтому мн. реакции в ряду Т. сопровождаются поликонденсацией (смолообразованием) и деструкцией. Т. достаточно гладко алкилируется лишь в мягких условиях при использовании более активных третичных и вторичных (но не первичных) алкилгалогенидов. Т. и его замещенные, содержащие ориентанты I рода, очень легко ацилируются в присутствии SnCl4 или SnCl2 в бензоле, который в этих условиях не ацилируется. Формилирование Т. протекает под действием ДМФА или N-метилформанилида в присутствии POCl3; взаимод. с альдегидами и кетонами в присутствии апротонных или протонных кислот приводит к образованию соед. ряда ди(2-тиенил)метана.
Т. и его производные способны к прямому металлированию под действием литийорг. соед. по механизму т. наз. протофильного замещения. Реакция протекает быстро и практически количественно при комнатной температуре в большинстве случаев с высокой региоспецифичностью с образованием α-металлированных производных. В очень мягких условиях ( −70 °C) под действием C4H9Li протекает также реакция обмена атома галогена в цикле Т. на металл, причем обмен галогена в α-положении предпочтительнее, чем в β-положе-нии, а обмен I на Li идет легче, чем Вг. В реакции нуклеоф. замещения легко вступают гл. обр. замещенные Т., содержащие в цикле ориентанты II рода.
Т., его гомологи и некоторые производные способны к реакциям радикального замещения, напр. арилированию по Гомберга-Бахмана-Хея реакции. Др. важнейший способ арилирования-УФ облучение иодтиофена в ароматич. растворителе или иодпроизводного ароматич. характера в Т.
Свойства непредельных соед. выражены в Т. слабо. Так, в диеновый синтез вступают только конденсированные Т., напр. замещенные бензо[с]тиофена. Гидрирование в ряду Т. идет обычно с трудом, что связано с его отравляющим действием на мн. катализаторы. Тем не менее Т. в присутствии Pd/C, MoS2 и др. превращ. в тетрагидротиофен (тиофан, т. пл. −96,2 °C, т. кип. 121,1 °C, 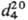 0,9987,
0,9987, 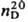 1,54048).
1,54048).
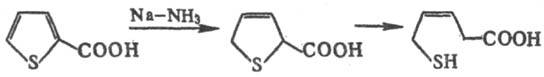
Гомологи Т. и мн. замещенные легко превращ. в соответствующие производные тиофана в условиях ионного гидрирования, напр. при действии трифторуксусной кислоты и три-этилсилана. Дигидротиофен образуется при восстановлении Т. Na в жидком NH3. При аналогичном восстановлении гомологов Т. и его производных процесс обычно не останавливается на стадии образования дигидропроизводных, а происходит расщепление цикла с образованием соответствующих соед. алифатич. ряда, напр.:
При действии скелетного Ni с участием адсорбированного H2 идет восстановит. десульфуризация замещенных Т. с образованием алифатич. соединений:
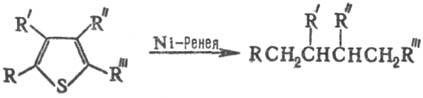
Эта реакция — один из путей получения из производных Т. соед. разл. классов, напр. карбоновых кислот, высших спиртов, простых эфиров, аминоспиртов и аминокислот, а также лакта-мов макроциклич. кетонов, кетокислот и кетолактонов.
Т. и его замещенные сравнительно устойчивы к действию окислителей. Однако при действии H2O2 или надкислот происходит окисление до сульфоксида (в своб. состоянии не выделен) или до сульфона. Оба эти соед. представляют собой типичную диеновую систему, способную, напр., к диеновому синтезу, в котором они могут выполнять роль как диена, так и диенофила.
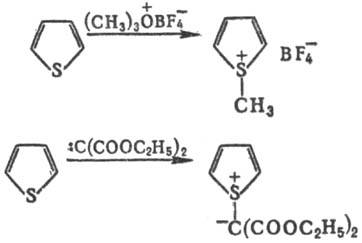
Под действием некоторых алкилирующих агентов или ди-(этоксикарбонил)карбена образуются производные Т. с положительно заряженным трехвалентным (сульфониевым) атомом серы, напр.:
Т. и его гомологи содержатся в продуктах коксования каменного угля (откуда их и выделяют вместе с кам.-уг. бензолом) и продуктах термич. разложения сланцев (в некоторых фракциях до 70% по массе). В сыром бензоле содержание Т. составляет 1,3–1,4%, в получаемом из сырого бензола тиофено-бензольном концентрате-30–35%. Осн. сырье для синтеза Т. и его гомологов-углеводороды нефтяных фракций C4 и C5, из которых они м. б. получены термич. взаимод. с S или каталитич. реакцией с H2S или SO2. Т. синтезируют также пропусканием фурана, ацетилена или 1,3-бутадиена и H2S над Al2O3. Гомологи Т., а также некоторые производные получают замыканием соответствующих 1,4-дикарбонильных соед. с помощью P2S5, напр.:
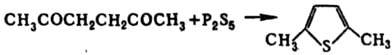
Соед. ряда Т. — реагенты для разделения элементов, оптич. отбеливатели (на основе 2,5-тиофендикарбоновой кислоты), физиологически активные соединения. Мн. производные Т. — лек. препараты (напр., антигельминтный препарат комбан-трин, модифицир. антибиотики цефалотин, цефалоридин), мономеры для получения электропроводящих полимеров.
Лит.: Блике Ф., в сб.: Гетероциклические соединения, под ред. Р. Эльдер-филда, пер. с англ., т. 1, М., 1953; Новые направления химии тиофена, М., 1976; Беленький Л. И., Гультяй В. П., "Химия гетероцикл. соединений", 1981, № 6, с. 723–43; Общая органическая химия, пер. с англ., т. 9, М., 1985, с. 229–93; Анисимов А. В., Викторова Е.А., Данилова Т. А., Молекулярные перегруппировки сероорганических соединений, М., 1989.
Л. И. Беленький
Значения в других словарях
- Тиофен — Гетероциклическое соединение, бесцветная жидкость с запахом, напоминающим запах бензола; tnл —38,3 °С, tкип 84,1 °С; плохо растворим в воде, хорошо — в органических растворителях. Большая советская энциклопедия
- тиофен — орф. тиофен, -а Орфографический словарь Лопатина
- Тиофен — (хим.) C4H4S. — Подобно бензолу, Т. является представителем большой группы соединений. По физическим и химическим свойствам Т. весьма сходен с бензолом, а производные... Энциклопедический словарь Брокгауза и Ефрона
- ТИОФЕН — ТИОФЕН — бесцветная жидкость, tкип 84,2 °С. Обладает ароматическими свойствами. Содержится вместе с бензолом в каменноугольной смоле. Значительные количества тиофена и его алкилпроизводных входят в состав сланцевой смолы. Большой энциклопедический словарь
