сульфаминовая кислота
СУЛЬФАМИНОВАЯ КИСЛОТА (моноамид серной кислоты, амидосерная кислота) NH2SO2OH
мол. м. 97,098; бесцветные кристаллы ромбич. сингонии, а — 0,8036 нм, b = 0,8025 нм, с = 0,9236 нм, z = 8; т. пл. 205 °C; плотн. 2,126 г/см3 (25 °C); 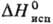 1147,6 кДж/кг,
1147,6 кДж/кг, 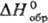 −685,9 кДж/моль; К 1,006 (вода, 25 °C); pH 1н. раствора 0,41 (25 °C). Растворимость в воде (г в 100 г): 12,80 (0 °C), 17,57 (20 °C), 22,77 (40 °C), 27,06 (60 °C), 32,01 (80 °C). Растворимость в органических растворителях при 25 °C (% по массе): в формамиде-0,18, метаноле-0,4, ацетоне-0,04, диэтиловом эфире-0,01.
−685,9 кДж/моль; К 1,006 (вода, 25 °C); pH 1н. раствора 0,41 (25 °C). Растворимость в воде (г в 100 г): 12,80 (0 °C), 17,57 (20 °C), 22,77 (40 °C), 27,06 (60 °C), 32,01 (80 °C). Растворимость в органических растворителях при 25 °C (% по массе): в формамиде-0,18, метаноле-0,4, ацетоне-0,04, диэтиловом эфире-0,01.
В кристаллич. состоянии С. к, образует цвиттер-ион 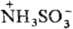 . При нагр. до 260 °C разлагается на SO2, SO3, N2 и H2O. При комнатной температуре С. к. практически не подвергается гидролизу, при повышенных температурах гидролизуется до (NH4)2SO4 (в кислой среде скорость гидролиза увеличивается). С металлами, их оксидами, гидроксидами и карбонатами С. к. образует соли NH2SO3M (сульфаматы), с тионилхлоридом-сульфамоилхлорид NH2SO2C1; при взаимодействии с HNO2 подвергается окислит. дезамини-рованию: NH2SO3H + HNO2 → H2O + N2 + H2SO4. Последнюю реакцию используют для количеств. определения С. к. и для разложения избытка HNO2 в производстве азокрасителей.
. При нагр. до 260 °C разлагается на SO2, SO3, N2 и H2O. При комнатной температуре С. к. практически не подвергается гидролизу, при повышенных температурах гидролизуется до (NH4)2SO4 (в кислой среде скорость гидролиза увеличивается). С металлами, их оксидами, гидроксидами и карбонатами С. к. образует соли NH2SO3M (сульфаматы), с тионилхлоридом-сульфамоилхлорид NH2SO2C1; при взаимодействии с HNO2 подвергается окислит. дезамини-рованию: NH2SO3H + HNO2 → H2O + N2 + H2SO4. Последнюю реакцию используют для количеств. определения С. к. и для разложения избытка HNO2 в производстве азокрасителей.
Хлор, бром, хлораты и KMnO4 окисляют С. к. до H2SO4 и N2; реакция с HClO или NaClO приводит к N-хлор- или N,N-дихлорпроизводным; реакция с Na в жидком NH3 — к NaSO3NHNa, а с Na2SO4-K аддукту 6HSO3NH2∙5Na2SO4∙15H2O.
С. к. реагирует с фенолами, первичными и вторичными спиртами, напр.: C6H5OH + NH2SO3H → C6H5OSO3NH4 → HOC6H4SO2ONH4. Первичные, вторичные и третичные амины образуют с С. к. аминосульфаматы RNH2∙HOSO2NH2 (ариламиносульфаматы, как правило, неустойчивы), амиды карбоновых кислот — N-ацилсульфаматы аммония, напр.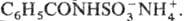
В промышленности С. к. получают взаимод. мочевины с SO3 и H2SO4: NH2CONH2 + SO3 + H2SO4 → 2NH2SO3H + CO2. С. к. может быть получена также; взаимод. мочевины с ClSO2OH, SO2 с NH2OH или SO3 с NH3 в безводной среде и др.
Для идентификации С. к. используют реакцию с HNO2, сплавление с бензоином и др.
С. к. применяют для очистки пром. аппаратов и оборудования (входит в состав антинакипинов), для введения групп SO3H и NHSO3H в орг. соед., в качестве стандартного вещества в ацидиметрии, для определения нитрит-ионов. Суль-фамат аммония NH2SO3NH4 применяют для придания огнезащитных свойств текстильным материалам, сульфамат никеля (NH2SO3)2Ni-KaK компонент электролитов для никелирования, N-хлорпроизводные С.к. — в качестве дезинфицирующих средств. Соли циклогексилсульфаминовой кислоты C6H11NHSO3M (цикламаты, напр. М = Na, К) производились в США как малокалорийные заменители сахара, однако из-за канцерогенных свойств их производство запрещено.
С. к. вызывает ожоги кожных покровов и слизистых оболочек. ЛД50 1600 мг/кг (крысы), 3100 мг/кг (мыши). Обладает значительно меньшей коррозионной активностью, чем соляная и серная кислоты.
Лит.: Andrieth L., Andersen К., "Chem. Rev.", 1940, v. 26, p. 49; Kirk-Othmer encyclopedia, 3 ed., v. 21, N.Y., 1983, p. 949; Gmelin, v. 9, p. 1582.
Н. А. Тилькунова
Значения в других словарях
- Сульфаминовая кислота — См. Сера. Энциклопедический словарь Брокгауза и Ефрона
