сероуглерод
СЕРОУГЛЕРОД (дисульфид углерода) CS2
мол. м. 76,143; бесцветная жидкость с приятным запахом, под действием света разлагается, продукты разложения придают желтый цвет и отвратит. запах. Молекула CS2 линейна, длина связи С — S 0,15529 нм; энергия диссоциации 1149 кДж/моль. Т. пл. −111,9 °C, т. кип. 46,24 °C; плотн. 1,2927 г/см3 (0 °C), 1,2630 г/см3 (20 °C); 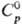 75,56 Дж/(моль∙К);
75,56 Дж/(моль∙К); 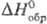 89,41 кДж/моль, ΔHпл 4,39 кДж/моль,
89,41 кДж/моль, ΔHпл 4,39 кДж/моль, 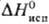 27,4 кДж/моль; S0298 151.3 Дж/(моль∙К); tкрит 273,05 °C, pкрит 7,90 МПа, dкрит 0,44 г/см3;
27,4 кДж/моль; S0298 151.3 Дж/(моль∙К); tкрит 273,05 °C, pкрит 7,90 МПа, dкрит 0,44 г/см3; 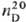 1,62546; ε 2,625(25 °C); η 0,365∙10−7 Па∙c (20 °C); γ 3,24∙104 Н/см (20 °C); уравнение температурной зависимости давления пара lgp( мм рт. ст.) =-1385,15/T+7,180+ + 2,088∙10−2lgT — 0,29294∙10−3T(161
1,62546; ε 2,625(25 °C); η 0,365∙10−7 Па∙c (20 °C); γ 3,24∙104 Н/см (20 °C); уравнение температурной зависимости давления пара lgp( мм рт. ст.) =-1385,15/T+7,180+ + 2,088∙10−2lgT — 0,29294∙10−3T(161 T
T 319 К), в паре-молекулы CS2. Твердый С. кристаллизуется в тетрагон/ решетке (при — 185 °C а = 0,812 нм, с = 0,377 нм, z = 3).
319 К), в паре-молекулы CS2. Твердый С. кристаллизуется в тетрагон/ решетке (при — 185 °C а = 0,812 нм, с = 0,377 нм, z = 3).
В инертной атмосфере С. заметно разлагается выше 300 °C с образованием графита и паров S. Легко воспламеняется на воздухе ниже 100 °C, горит с образованием CO2 и SO2. Растворимость С. в воде (г в 100 г): 0,26 (0 °C), 0,19 (30 °C). Ок. −3 °C образуется гидрат 2CS2 ∙ H2O. Гидролизуется водой выше 150 °C с образованием CO2, COS, H2S. С этанолом, диэтиловым эфиром, CHCl3 смешивается во всех соотношениях. С. — прекрасный растворитель жиров, масел, смол, каучуков; растворяет S, P, I2.
При взаимодействии с сульфидами щелочных металлов С. образует тиокарбонаты. Со спиртовыми растворами щелочей дает ксантогенаты. С. хлорируется в присутствии катализаторов: CS2 + 3Cl2 → CCl4 + S2Cl2 2S2Cl2+CS2 → CCl4 + 6S
Легко обменивает S на кислород при нагр. с оксидами металлов.
В промышленности С. получают реакцией CH4 или прир. газа с парами S в присутствии силикагеля при 500–700 °C в камере из хромоникелевой стали. С. получают также взаимод. древесного угля и паров S при 750–1000 °C; по одному способу уголь загружают на дно реторты из нержавеющей стали, жидкая S поступает из плавильного чана, по электротермич. методу уголь помещают между электродами. Выделяют С. дистилляцией. Применяют для получения ксантогенатов целлюлозы в производстве вискозы, дитиокарбоковых кислот (напр., 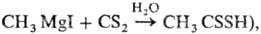 для пром. синтеза CCl4, как растворитель, экстрагент, вулканизующий агент для каучука.
для пром. синтеза CCl4, как растворитель, экстрагент, вулканизующий агент для каучука.
С. токсичен, поражает нервную и сердечно-сосудистую системы; ПДК в воздухе рабочей зоны 1 мг/м3, в атм. воздухе 0,005 мг/м3. Пожароопасен, т. вел. −30 °C. КПВ 1,25–50% по объему. Хранят С. под слоем воды.
И. Н. Один
Значения в других словарях
- Сероуглерод — CS2, соединение серы с углеродом. Бесцветная жидкость, плотность 1,2927 г/см3, tkип 46,26°С, tпл — 112,1°С. Растворимость в воде незначительна, со спиртом, эфиром и хлороформом С. смешивается в любых пропорциях. Пары при 236 °С воспламеняются. Большая советская энциклопедия
- сероуглерод — -а, м. Бесцветная, легко воспламеняющаяся ядовитая жидкость с неприятным запахом. Малый академический словарь
- сероуглерод — Сер/о/углеро́д/. Морфемно-орфографический словарь
- сероуглерод — орф. сероуглерод, -а Орфографический словарь Лопатина
- сероуглерод — СЕРОУГЛЕРОД, химич. соединение серы с углеродом. Бесцветная жидкость со своеобразным запахом; очень мало растворим в воде; хороший растворитель для жиров, масел, серы, фосфора и др. В лечебной вет. Ветеринарный энциклопедический словарь
- сероуглерод — СЕРОУГЛЕРОД -а; м. Соединение серы с углеродом; бесцветная, легковоспламеняющаяся ядовитая жидкость с неприятным запахом. Толковый словарь Кузнецова
- сероуглерод — СЕРОУГЛЕРОД, а, м. Бесцветная летучая ядовитая горючая жидкость с неприятным эфирным запахом. | прил. сероуглеродный, ая, ое. Толковый словарь Ожегова
- сероуглерод — СЕРОУГЛЕР’ОД, сероуглерода, мн. нет, ·муж. (·хим. ). Бесцветная, легко воспламеняющаяся ядовитая жидкость с неприятным запахом, применяющаяся в химической промышленности, в сельском хозяйстве для борьбы с вредителями и др. Толковый словарь Ушакова
- СЕРОУГЛЕРОД — СЕРОУГЛЕРОД — CS2, бесцветная летучая жидкость с эфирным запахом, tкип 46,2 °С. На свету желтеет; отвратительно пахнет из-за частичного разложения. Растворяет жиры, масла, смолы, каучуки, серу, иод и др. Большой энциклопедический словарь
- сероуглерод — сероуглерод м. Соединение серы с углеродом — бесцветная, легко воспламеняющаяся ядовитая жидкость, с неприятным запахом. Толковый словарь Ефремовой
- Сероуглерод — CS2 (сернистый углерод, хим.-техн.) — С. открыт Лампадиусом в 1796 г.; он представляет бесцветную, легкоподвижную жидкость с приятным эфирным запахом, когда он чист; уд. в. его при 0° — 1,2922; 15° — 1,2708; 20° — 1,2636; при темп. кип. — 1,2233 (уд. Энциклопедический словарь Брокгауза и Ефрона
