рутений
РУТЕНИЙ (от ср.-век. лат. Ruthenia-Россия; ruthenium) Ru
хим. элемент VIII гр. периодической системы, ат. н. 44, ат. м. 101,07; относится к платиновым металлам. В природе встречается семь стабильных изотопов: 96Ru (5,7%), 98Ru (2,2%), 99Ru (12,8%), 100Ru (12,7%), 101Ru (17,0%), 102Ru (31,3%), 104Ru (18,3%). Конфигурация внеш. электронных оболочек атома 4d75s1. Наиб. характерные степени окисления +3, +4, +6, +8; энергии ионизации Ru0 : Ru1+ : Ru2+ : Ru3+ соотв. 7,366, 16,763 и 28,46 эВ; атомный радиус 0,134нм, ионные радиусы (в скобках указаны координац. числа) Ru3+ 0,082 нм (6), Ru4+ 0,076 нм (6), Ru5+ 0,071 нм (6), Ru7+ 0,052 нм (4), Ru8+ 0,050 нм (4).
Р. — редкий рассеянный элемент. Содержание в земной коре 5–10 % по массе. Собств. минералы-лаурит (RuS2), py-тенарсенид (RuAs)-очень редки. Вместе с др. платиновыми металлами Р. содержится в рутениевом невьянските (Ir, Os, Ru), рутениевом сысертските (Os, Ir, Ru), самородной платине, осрутине (Os, Ru), в виде изоморфной примеси — в пент-ландите, пирротине, кубаните, халькопирите (в медно-никелевых месторождениях).
Свойства. Р. — блестящий серебристый металл. Кристаллич. решетка гексагональная типа Mg, а = 0,27054 нм, с = 0,42825 нм, z = 2, пространственная группа P63/mmc; т. пл. 2334 °C, т. кип. 4077 °C; плотн. 12,45 г/см3;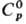 24,0 Дж/(моль∙К);
24,0 Дж/(моль∙К); 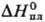 38,3 кДж/моль,
38,3 кДж/моль, 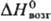 647,4 кДж/моль;
647,4 кДж/моль; 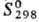 28,56 Дж/(моль∙К); теплопроводность при 100 К монокристалла перпендикулярно оси с 140Вт/(м∙К), параллельно оси с 180Вт/(м∙К), для поли-кристаллич. 150 Вт/(м∙К); температурный коэф. линейного расширения для монокристалла перпендикулярно оси с 5,8∙10−6К−1 (300К), 7,95∙10−6K−1 (1000 К). 13,02∙10−6 К−1 (2000 К), параллельно оси с 8,7∙10−6К−1 (300 К), 1,181∙10−5K−1 (1000 К), 1,815∙10−5 (2000 К); ρ при 273 К для монокристалла перпендикулярно оси с 3,16∙10−7 Ом∙м, параллельно оси с 2,17∙10−7 Ом∙м, для поликристаллич. 2,83∙10−7 Ом∙м; парамагнетик, уд. магн. восприимчивость при 100 К для монокристалла перпендикулярно оси с + 4,15∙10−5, параллельно оси с + 3,20∙10−5, для поликристаллич. 3,81∙10−5; отражат. способность для электрополированного монокристалла 71,1% (λ = = 0,265 мкм), 75,0% (0,302 мкм), 72,0% (0,404 мкм), 69,3% (0,500 мкм), 70,8% (0,600 мкм); коэф. Холла для поликристаллич. (99,8%-ной чистоты) +9,5∙10−1 м3/Кл (100 К), +7,0∙10−11 м3/Кл (290 К), +4,5∙10−1 м3/Кл (700 К), для монокристалла при 293 К перпендикулярно оси с + 1,75∙10−10 м3/Кл, параллельно оси с +1,11∙10−10 м3/Кл. Модуль Юнга 485,4 ГПа, σраст 172 ГПа, коэф. Пуассона 0,31; для отожженного образца техн. чистоты: модуль Юнга 430 ГПа, твердость по Бринеллю 2000–3000 МПа, условный предел текучести при растяжении 350–400 МПа (остаточная деформация 0,2%), 500–600 МПа (остаточная деформация 13%), относит. удлинение 3–10%, сужение 2–3%. Поликристаллический Р. с трудом поддается пластич. деформированию выше 1500 °C. Рафинированный зонной плавкой монокристаллический Р. пластичен при комнатной температуре.
28,56 Дж/(моль∙К); теплопроводность при 100 К монокристалла перпендикулярно оси с 140Вт/(м∙К), параллельно оси с 180Вт/(м∙К), для поли-кристаллич. 150 Вт/(м∙К); температурный коэф. линейного расширения для монокристалла перпендикулярно оси с 5,8∙10−6К−1 (300К), 7,95∙10−6K−1 (1000 К). 13,02∙10−6 К−1 (2000 К), параллельно оси с 8,7∙10−6К−1 (300 К), 1,181∙10−5K−1 (1000 К), 1,815∙10−5 (2000 К); ρ при 273 К для монокристалла перпендикулярно оси с 3,16∙10−7 Ом∙м, параллельно оси с 2,17∙10−7 Ом∙м, для поликристаллич. 2,83∙10−7 Ом∙м; парамагнетик, уд. магн. восприимчивость при 100 К для монокристалла перпендикулярно оси с + 4,15∙10−5, параллельно оси с + 3,20∙10−5, для поликристаллич. 3,81∙10−5; отражат. способность для электрополированного монокристалла 71,1% (λ = = 0,265 мкм), 75,0% (0,302 мкм), 72,0% (0,404 мкм), 69,3% (0,500 мкм), 70,8% (0,600 мкм); коэф. Холла для поликристаллич. (99,8%-ной чистоты) +9,5∙10−1 м3/Кл (100 К), +7,0∙10−11 м3/Кл (290 К), +4,5∙10−1 м3/Кл (700 К), для монокристалла при 293 К перпендикулярно оси с + 1,75∙10−10 м3/Кл, параллельно оси с +1,11∙10−10 м3/Кл. Модуль Юнга 485,4 ГПа, σраст 172 ГПа, коэф. Пуассона 0,31; для отожженного образца техн. чистоты: модуль Юнга 430 ГПа, твердость по Бринеллю 2000–3000 МПа, условный предел текучести при растяжении 350–400 МПа (остаточная деформация 0,2%), 500–600 МПа (остаточная деформация 13%), относит. удлинение 3–10%, сужение 2–3%. Поликристаллический Р. с трудом поддается пластич. деформированию выше 1500 °C. Рафинированный зонной плавкой монокристаллический Р. пластичен при комнатной температуре.
По химическим свойствам Р. — типичный представитель платиновых металлов. Стандартный электродный потенциал Ru2+ /Ru0 + 0,45 В. Р. проявляет все степени окисления от 0 до +8. Простые соединения Р. обычно трудно получить в чистом виде. В растворах существуют только комплексные ионы.
Компактный Р. не окисляется на воздухе до 930 °C; не раств. в растворах щелочей, а также в H2SO4, HNO3, H3PO4, соляной, фтористоводородной и уксусной кислотах, царской водке. Порошкообразный Р. при нагр. окисляется O2 до RuO2. Мелкодисперсный Р. (чернь) взрывает на воздухе самопроизвольно. Губчатый Р. при нагр. медленно раств. в растворе NaClO, в растворах Cl2 в соляной кислоте, Br−2 — в бромистово-дородной кислоте, I2- в этаноле; взаимод. с галогенами, S, Se, Те, поглощает H2 с образованием твердых растворов. С N2 металлический Р. не взаимод., но комплексные соединения Р. могут связывать азот воздуха, напр. [{Ru(NH3)5}2N2][BF4]4. Р. сплавляется с большинством металлов. С переходными металлами образует твердые растворы и промежут. фазы структурного типа CsCl и Cr3Si, а также σ-фазы и фазы Лавеса (см. интерметаллиды). Р. переводят в раствор путем сплавления его со смесью KNO3 и КОН, пероксидами Ba или Na при 530 °C с послед. выщелачиванием плава, хлорированием смеси шихты Р. с KCl при ~530 °C и дальнейшим выщелачиванием разб. соляной кислотой.
Тетраоксид RuO4-золотисто-желтые кристаллы; т. пл. 25,5 °C, т. кип. 27 °C, т. разл. 108 °C; плотн. 3,29 г/см3 (21 °C); ΔH0обр −305,2 кДж/моль; растворимость в воде (г в 100 г): 2,033 (20 °C), 2,249 (74 °C); раств. в спиртах, CCl4; окислитель; взаимод. с разб. соляной кислотой, давая хлорорутенаты. Получают взаимод. K2RuO4 с KOH и Cl2 либо K2RuO4 с KMnO4, или КIO4 и H2SO4; промежут. продукт при получении Р. при селективном выделении в аналит. химии; тетраоксид 105Ru извлекают из продуктов деления U и Pu.
Диоксид RuO2-темно-синие кристаллы тетрагон. сингонии (а = 4,4919 нм, с = 0,31066 нм, пространственная группа P42/тпт); т. разл. 730–750 °C; плотн. 6,97 г/см3; не раств. в воде, кислотах и щелочах при кипячении; при 400 °C восстанавливается H2 до металла; взаимод. с оксидами (PbO, BaO, SrO, Bi2O3), давая рутенаты(IV), обладающие металлич. типом проводимости, сам RuO2 также электропроводен; при 298 К ρ для RuO2 4∙10−3Ом∙м, SrRuO3 4∙10−2Ом∙м, BaRuO3 6,5∙10−2 Ом∙м, Pb2Ru2O6 3,0∙10−2 Ом∙м, Bi2Ru2O7 4,7∙10−1 Ом∙м; получают прокаливанием выше 500 °C на воздухе Ru(OH)4, (NH4)2[RuCl6], (NH4)2[Ru(NO)Cl5]. RuO2 и рутенаты-резисторные материалы в микроэлектронике. Гидроксид Ru(OH)4-черное аморфное вещество; получают восстановлением K2RuO4 этанолом, гидролитич. разложением солей Ru(IV); применяют в аналит. химии для концентрирования Р. из растворов, осаждения Р. при его производстве.
Дисульфид RuS2-темно-зеленые кристаллы кубич. сингонии (z = 4, пространственная группа Ра3, для минерала лаури-та а — 0,560 нм) или черное аморфное вещество; т. разл. 1000 °C; плотн. 6,99 г/см3; 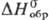 −197 кДж/моль; не взаимод. со щелочами и кипящей H2SO4; образуется при взаимодействии H2S с растворами солей Ru(IV); используется для выделения Р. из растворов при его получении в аналит. химии.
−197 кДж/моль; не взаимод. со щелочами и кипящей H2SO4; образуется при взаимодействии H2S с растворами солей Ru(IV); используется для выделения Р. из растворов при его получении в аналит. химии.
Пентафторид RuF5-темно-зеленые кристаллы; т. пл. 85,4 °C, т. кип. 227 °C; гигроскопичен; гидролизуется водой; получают взаимод. Ru с F2 при 300–450 °C.
Трихлорид RuCl3-черные или коричневые кристаллы, т. возг. 777 °C, т. разл. выше 500 °C; плотн. 3,11 г/см3; 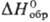 −205 кДж/моль; не раств. в воде, раств. в соляной кислоте; получают взаимод. Ru с Cl2 в присутствии CO при 330 °C; применяют при получении рутениевой черни и соед. Ru (карбонилов, рутеноцена и др.).
−205 кДж/моль; не раств. в воде, раств. в соляной кислоте; получают взаимод. Ru с Cl2 в присутствии CO при 330 °C; применяют при получении рутениевой черни и соед. Ru (карбонилов, рутеноцена и др.).
Рутенат(VI) калия K2RuO4-черно-зеленые кристаллы; т. разл. 440 °C; раств. в воде и растворах щелочей, в кислотах диспропорционирует на Ru(IV) и Ru(VII); получают сплавлением Р. с KOH и KNO3 или K2O2; промежут. продукт при аффинаже Р., используется также для приготовления катализаторов на носителях.
"Рутениевая красная соль" [Ru3O2(NH3)14]Cl6∙4H2O-красные кристаллы; раств. в воде; получают длит. нагреванием растворов соед. Ru(III) и NH3; применяют для гис-тологич. исследований животных и растит. тканей, как краску для фарфора. "Бурая соль" K4[Ru2OCl10]∙H2O-бурые кристаллы; раств. в воде, не раств. в органических растворителях; получают взаимод. RuO4 с раствором KCl в соляной кислоте или восстановлением K2RuO4 в соляной кислоте спиртом; промежут. продукт при получении солей Ru(IV), Ru(OH)4, RuO2. Гексахлорорутенат(IV) аммония (NH4)2[RuCl6]-черные кристаллы; т. разл. 360 °C; плохо раств. в во'де, раств. в неорг. кислотах; получают взаимод. RuO4 с насыщ. раствором NH4C1 в конц. соляной кислоте; промежут. продукт при аффинаже Р., при получении RuO2.
Аквапентахлорорутенат(III) калия K2[Ru(H2O)Cl5]-темно-красные кристаллы; т. разл. 180 °C; раств. в воде и неорг. кислотах; получают кипячением K4[Ru2OCl10] в смеси соляной кислоты и этанола; применяют при получении Р. и соед. Ru(III).
Нитрозопентахлорорутенат(III) аммония (NH4)2[Ru(NO)Cl5]-малиново-красные кристаллы; т. разл. 320 °C; раств. в воде; получают взаимод. соед. Ru(III) или Ru(IV) с царской водкой и послед. удалением HNO3 и осаждением насыщ. водным раствором NH4C1; промежут. продукт при получении RuO2 и нитрозокомплексов Ru(IV). Нитрозотринитрорутений(III) [Ru(NO)(NO3)3]∙H2O-темно-вишневое твердое гигроскопичное вещество; раств. в воде, кислотах, растворах щелочей, органических растворителях; получают взаимод. RuO4 с конц. HNO3 при нагр.; образуется при переработке облученного ядерного топлива. Гидроксонитрозотетра-нитрорутенат(III) натрия Na2[Ru(NO)(NO2)4(OH)]∙2H2O-оранжевые кристаллы; ок. 100 °C обезвоживается, ок. 200 °C разлагается; раств. в воде, ацетоне, этаноле; получают взаимод. соед. Ru(III) или Ru(IV) с насыщ. водным раствором NaNO2; применяют для нанесения рутениевых покрытий на металлы, керамику.
Пентакарбонил Ru(CO)5-летучая жидкость; т. пл. −22 °C; не раств. в воде, раств. в органических растворителях; получают взаимод. RuI3 с CO при 170 °C (4,4 МПа) в присутствии Ag; применяют для нанесения рутениевых покрытий из газовой фазы на металлы, стекло, керамику. Ацетилацетонат Ru(CH3COCH2COCH3 )3 — кроваво-красные кристаллы; т. пл. 76,4 °C; не раств. в воде, раств. в органических растворителях; получают взаимод. RuCl3 с ацетилацетоном и K2CO3; применяют для нанесения рутениевых покрытий из газовой фазы на металлы, стекло, кварц, керамику, для получения рутеноцена.
• см. также рутенийорганические соединения
Получение. Остатки после аффинажа шлиховой Pt или концентраты после переработки шламов электрорафинирования черновых Cu и Ni сплавляют с BaO2 или Na2O2, раств. в воде, на раствор действуют Cl2, отгоняют образовавшийся RuO4, который поглощают из газов соляной кислотой; затем осаждают (NH4)2 [RuCl6], прокаливают его до RuO2 и восстанавливают в токе H2, получая рутениевый порошок 99,9%-ной чистоты. Выплавляют Р. и его сплавы в индукц. печах (в тиглях из стабилизированного ZrO2 или электро-плавленного магнезита) либо в дуговых печах в среде Ar или в вакууме.
Значит. количества радиоактивного Р. предполагается извлекать из радиоактивных отходов, образующихся при работе АЭС.
Применение. Легирующие добавки Р. значительно повышают прочность, твердость, термич. и коррозионную стойкость сплавов. Р. — компонент сплавов с Pt и Rh (для фильер, используемых в производстве стекловолокна и вискозы), с Ir, Os, W (для перьев авторучек), с Ir (для высокотемпературных термопар, эксплуатируемых до 2000 °C), с Pt и Pd (для изготовления износостойких деталей разл. измерит. приборов, электроконтактов, ювелирных изделий). Р. и его сплавы с Pd, нанесенные в виде черней на носители,-катализаторы гидрирования и дегидрирования орг. соединений. Р. используют также для нанесения защитных покрытий на электрич. контакты. Радиоактивные 103Ru (T1/2 39,8 сут) и 106Ru (T1/2 1 ч)-изотопные индикаторы.
Мировое производство Р. (без СНГ) не превышает 10 т/год.
Летучие и растворимые соединения Р. вызывают аллергию, раздражают слизистые оболочки, могут вызывать их изъязвление. ПДК в воздухе рабочей зоны для RuO2 1 мг/м3.
Р. открыл К. К. Клаус в 1844.
Лит.: Синицын Н. М., в кн.: Благородные металлы я их заменители, Свердловск, 1971; Раевская М. В., Соколовская Е. М., Физикохимия рутения и его сплавов, М., 1979; Seddon E. А., Seddon K. R., The chemistry of ruthenium, Amst., 1984.
Н. М. Синицын
Значения в других словарях
- Рутений — (лат. Ruthenium) Ru, химический элемент VIII группы периодической системы Менделеева, атомный номер 44, атомная масса 101,07; один из платиновых металлов (См. Платиновые металлы). Большая советская энциклопедия
- рутений — -я, м. Химический элемент, серовато-белый твердый металл платиновой группы, идущий на изготовление перьев, ювелирных изделий, лабораторной посуды и др. [От лат. ruthenus — русский] Малый академический словарь
- рутений — Руте́н/ий/. Морфемно-орфографический словарь
- рутений — орф. рутений, -я Орфографический словарь Лопатина
- РУТЕНИЙ — РУТЕНИЙ (символ Ru), серебристо-белый ПЕРЕХОДНЫЙ ХИМИЧЕСКИЙ ЭЛЕМЕНТ, впервые открыт в 1827 г. Встречается в ПЛАТИНОВЫХ рудах. Используется в качестве КАТАЛИЗАТОРА, а также в электрических контактах в сплаве с другими платиновыми металлами... Научно-технический словарь
- Рутений — Ru (от cp.-век. лат. Ruthenia — Pоссия * a. ruthenium; н. Ruthenium; ф. ruthenium; и. rutenio), — хим. элемент VIII группы периодич. системы Mенделеева, ат. н. 44, ат. м. 101,07 относится к платиновым металлам. Горная энциклопедия
- рутений — РУТ’ЕНИЙ [тэ], рутения, мн. нет, ·муж. (от ·новолат. ruthenus — русский) (·хим. ). Химический элемент, серый, хрупкий тугоплавкий металл, встречаемый в природе вместе с платиной и идущий на изготовление волосков для ламп накаливания. Толковый словарь Ушакова
- рутений — РУТЕНИЙ [тэ], -я; м. Химический элемент (Ru), твёрдый серовато-белый металл (входит в состав многих сплавов, применяется для изготовления ювелирных изделий, лабораторной посуды и др.). ◁ Рутениевый, -ая, -ое. Толковый словарь Кузнецова
- рутений — РУТЕНИЙ м. один из металлов, отделяемых от платины. Толковый словарь Даля
- Рутений — (хим.; Ruthenium; Ru = 101,66 по А. Жоли, при O=16) — один из металлов группы платины (см.), открыт в 1845 году в лаборатории казанского университета профессором Клаусом при исследовании платиновой руды, т. е. самородной платины с Урала. Энциклопедический словарь Брокгауза и Ефрона
- рутений — [тэ], рутения, мн. нет, м. [от новолатин. ruthenus – русский] (хим.). Химический элемент, серый, хрупкий тугоплавкий металл, встречаемый в природе вместе с платиной и идущий на изготовление волосков для ламп накаливания. Большой словарь иностранных слов
- РУТЕНИЙ — РУТЕНИЙ (лат. Ruthenium) — Ru, химический элемент VIII группы периодической системы Менделеева, атомный номер 44, атомная масса 101,07, относится к платиновым металлам. Название от позднелат. Ruthenia — Россия (открыт К. К. Клаусом). Большой энциклопедический словарь
- рутений — рутений м. Химический элемент — серый, хрупкий, тугоплавкий металл платиновой группы, из которого изготовляются волоски для ламп накаливания. Толковый словарь Ефремовой
