реагенты органические
РЕАГЕНТЫ ОРГАНИЧЕСКИЕ в аналитической химии (ОР)
орг. соединения разл. классов, служащие для качеств. обнаружения или количеств. определения хим. элементов, функц. групп и соед., а также для разделения, концентрирования, маскирования и др. вспомогат. операций, предшествующих или сопровождающих определение веществ любыми методами.
История. С древнейших времен для обнаружения некоторых веществ (напр., серебра, железа) применяли прир. вещества (уксус, отвар чернильных орешков, винный камень, камфора, яичный желток, дубовая кора, хмель и др.). Ряд прир. орг. веществ использовал англ. ученый Р. Бойль. В нач. 19 в. русский химик В. М. Севергин опубликовал труды по аналит. химии, где в качестве ОР описал лакмусовую тинктуру, фиалковый сироп и др. В руководствах И. Берцелиуса, К. Фрезениуса и К. Мора также упоминались разл. природные ОР.
С кон. 19 в. начали применять синтетич. орг. соединения, в частности морин, флуоресцеин, α-нитрозо-β-нафтол, ксан-тогенаты, формальдоксим, 2,2'-дипиридил, 1,10-фенантро-лин, сульфаниловую кислоту (n-аминобензолсульфокислоту) и а-нафтиламин. Раствор последних двух реагентов в разб. CH3COOH наз. реактивом Грисса и до сих пор используется для определения и обнаружения ионов NO2 , с которыми он образует азокраситель красного цвета.
С именем Л. А. Чугаева связывают становление в 20 в. нового научного направления — целенаправленного синтеза и применения ОР в аналит. химии. Он впервые сформулировал некоторые положения теории действия ОР, образующих комплексные соединения. Предложенный ученым в 1905 реагент-диметилглиоксим широко применяют для определения никеля. Вскоре были синтезированы и введены в аналит. практику многие др. реагенты: дифенилкарбазид, куп-ферон, дитизон. Ф. Файгль (1931) развил учение о специфич. функцион. аналит. группировках в ОР.
С 30-х гг. 20 в. ОР становятся основой хим. методов анализа. Синтезируются новые ОР, напр. N-бензоил-N-фенилгидроксиламин, 8-гидроксихинолин, арсеназо, торон, интенсивно изучается механизм их действия.
Появление разнообразных физ.-хим. и физ. (электрохим., спектроскопич., ядерно-физ. и др.) методов анализа заметно снизило значение хим. методов вообще и ОР в частности.
Классификация. Разделить ОР на группы можно по разным принципам, напр. по хим. строению (по сходству углеродного скелета или по функц. группам), в зависимости от типа определяемых веществ (катионы металлов, анионы, орг. вещества), по областям аналит. применения — реагенты для гра-виметрич., титриметрич., фотометрич. или люминесцентного определения элементов, индикаторы, экстрагенты, маскирующие агенты и т. д.
Строение ОР. Аналит. свойства ОР во многом определяются т. наз. функционально-аналитической атомной группировкой (ФАГ), которая представляет собой группу атомов, непосредственно участвующих в аналит. хим. реакции. ФАГ могут быть, напр., группы OH, NH2, COOH, SH, AsO(OH)2. Природа ФАГ в большой степени определяет круг компонентов, взаимод. с ОР при данных условиях. Так, согласно т. наз. гипотезе аналогий, с ОР взаимод. те металлы, которые склонны образовывать устойчивые соед. с простыми неорг. веществами, содержащими атомы и группы атомов, которые входят в ФАГ молекулы реагента. Например, элементы, склонные давать устойчивые сульфиды, взаимод. с ОР, содержащими меркаптогруппу, а элементы, склонные давать устойчивые аммиакаты, — с ОР, содержащими аминогруппу, элементы, катионы которых склонны к гидролизу, — с ОР, содержащими гидроксигруппу. Это может служить основой для поиска новых ОР.
На аналит. свойства ОР могут оказывать влияние и др. функц. группы, которые иногда называют аналитико-активными. Во мн. случаях механизм аналит. реакций сложен. Например, в комп-лексообразовании с ионом металла в зависимости от условий реакции могут принимать участие разные функц. группы ОР; при координировании иона металла ФАГ может изменять свою структуру; могут образовываться димерные, смешанные и более сложные комплексные соединения. Помимо ФАГ у др. групп на аналит. свойства ОР влияет строение молекулы ОР в целом (ее углеродный скелет и π-электрон-ная структура).
Для изучения механизма действия ОР получают термодинамич. и кинетич. характеристики процессов, приводящих к определенному аналит. эффекту (образованию растворимого комплексного соед., осадка и т. д.), выясняют строение ОР и конечного продукта реакции при разных условиях. При этом используют электрохим. методы, спектрофотометрию, ЭПР, ЯМР, ИК спектроскопию и т. д. Вопрос о строении ОР и продуктов их взаимод., в частности комплексных соед. с элементами,- основа всех теоретич. построений, связанных с объяснением аналит. эффектов данного ОР и с возможностью прогнозировать свойства новых ОР.
Квантовохим. методы позволяют представить положение электронных энергетич. уровней ОР и его соединений с определяемыми веществами, предсказать относит. интенсивности полос поглощения в спектрах, а также сделать выводы о строении и характере связей в изучаемых веществах. Для расчетов наиб. широко применяют метод самосогласованного поля Хартри-Фока-Ругана (с использованием ЭВМ). Установлено, что обычно одна и та же ФАГ удовлетворяет координац. требованиям мн. катионов металлов, которые могут с ней взаимодействовать. Методы квантовой химии успешно применяют при исследовании реакц. способности ОР.
Избирательность (селективность). Для характеристики этого свойства обычно перечисляют хим. элементы (или хим. соед.), которые взаимод. с данным ОР при определенных условиях. Чем меньше таких элементов (соед.), тем выше избирательность. При использовании избират. ОР упрощаются методы определения, повышается их экспрессность и надежность. Специфичным называют ОР, взаимодействующий только с одним элементрм (хим. соед.). Таких ОР мало. Избирательность можно повысить, изменяя условия выполнения реакции или модифицируя структуру самого реагента, т. е. синтезируя аналоги данного ОР. Первый путь сводится к подбору оптим. условий выполнения реакции, в частности pH среды. Универс. способ повышения избирательности анализа — применение разл. маскирующих веществ, которые связывают компоненты, сопутствующие определяемому. Иногда при определении ионов металлов в реакц. систему вводят дополнительно хим. соединение, что приводит к образованию смешанно-лигандного комплексного соед. (т. е. соед., содержащего разл. лиганды), характерного только для определяемого элемента.
Чувствительность. Абс. количества элементов, которые м. б. обнаружены при помощи ОР, составляют 10−2–10−4 мкг. Примерами наиб. чувствительных реагентов могут служить дитизон, диметилглиоксим, арсеназо III, тиродин. Применение неводных растворителей в ряде случаев приводит к существ. повышению чувствительности качеств. анализа.
В спектрофотометрии характеристикой чувствительности является молярный коэф. поглощения е, который для некоторых комплексных соед. ОР с определяемыми элементами достигает ~106. ОР, добавляемые в анализируемые объекты, в ряде случаев могут в неск. раз повышать чувствительность физ. и физ.-хим. методов (напр., полярографии, атомно-абсорбц. анализа). Предварит. концентрирование (соосажде-нием, экстракцией) позволяют на 1–2, иногда 3–4 порядка понизить пределы обнаружения веществ.
Выбор ОР. Число предложенных ОР для разл. целей непрерывно возрастает и достигло неск. тысяч. Для выбора лучшего ОР сравнивают аналит. данные, характеризующие эффективность применения разных ОР для решения конкретной задачи, т. е. учитывают чувствительность и избирательность реагента, стабильность продукта реакции, значения pH среды в условиях определения (осаждения, разделения), контрастность в случае цветных реакций (т. е. изменение длины волны максимума поглощения ОР и продукта его взаимод.), скорость установления равновесия и др. Поскольку число избират. реагентов ограничено, часто для данного компонента (элемента) подбирают неск. ОР (ассортимент). В зависимости от предполагаемого содержания в анализируемом объеме мешающих элементов используют тот или иной ОР из ассортимента или один из ОР применяют для отделения, а другой-для определения исследуемого элемента.
ОР для осаждения веществ. Орг. осадители используются в гравиметрии для определения гл. обр. неорг. ионов. Например, диметилглиоксим осаждает Pd2+ и Ni2+, 8-гидроксихинолин-А13+, тетрафенилборат натрия-К+ и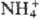 . Получаемые осадки практически не содержат адсорбированных, окклюдированных или др. примесей, легко фильтруются и промываются. После высушивания мн. из них могут служить весовой формой с хорошим фактором пересчета (см. гравиметрия). Благодаря избирательности ОР и растворимости мн. осадков в органических растворителях орг. осадители часто используют для разделения (отделения) элементов. Для выделения элементов из разб. растворов применяют орг. сооса-дители. Так, в виде комплекса с арсеназо I Am соосаждается с осадком, образованным арсеназо I и кристаллич. фиолетовым.
. Получаемые осадки практически не содержат адсорбированных, окклюдированных или др. примесей, легко фильтруются и промываются. После высушивания мн. из них могут служить весовой формой с хорошим фактором пересчета (см. гравиметрия). Благодаря избирательности ОР и растворимости мн. осадков в органических растворителях орг. осадители часто используют для разделения (отделения) элементов. Для выделения элементов из разб. растворов применяют орг. сооса-дители. Так, в виде комплекса с арсеназо I Am соосаждается с осадком, образованным арсеназо I и кристаллич. фиолетовым.
Лучшими осадителями (и соосадителями) являются ОР, содержащие гидрофобные заместители (фенильные, алкильные группы), нафталиновые и антрахиноновые ядра.
ОР применяют также для гравиметрич. определения и обнаружения (идентификации) орг. соединений (их функц. групп). Например, распространенным реагентом на карбонильную группу служит 2,4-дикитрофенилгидразин, образующий с альдегидами и кетонами окрашенные 2,4-дигидрофенил-гидразоны с четкими температурами плавления; для идентификации аминов получают их производные с такими ОР, как 3-нитро-фенилизоцианат, 3-нитрофталевый ангидрид, 4-нитробензоилхлорид, 4-толуолсульфохлорид.
ОР в титрнметрии. Легко получаемые в чистом виде и устойчивые ОР, из которых можно приготовить растворы точно известной концентрации (или быстро установить последнюю простыми методами), применяют в качестве первичных стандартов. Примерами таких ОР могут служить щавелевая, фталевая, янтарная, 4-нитробензойная кислоты, дифенил-гуанидин, N-бромсукцинимид. Растворы некоторых ОР пригодны в качестве титрантов. Например, растворы аскорбиновой кислоты (в аскорбинометрий) применяют для титрования окислителей-Fe(III), Hg(II), I2, Br2, 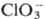 ,
, 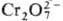 , а также нитро-, нитрозо-, азо- и имйногрупп в орг. соединениях; раствором N-бромсукцинимида титруют растворы As(III), Sb(III) и др. восстановителей, а гидрохинон служит титрантом для определения окислителей — Au (III), Ce(IV). Реагент Фишера (раствор I2 и SO2 в смеси пиридина и метанола) широко применяют для определения воды. Наиб. часто в качестве титрантов используют комплексоны, особенно динатриевую соль этилендиаминтетрауксусной кислоты (см. комплексонометрия). Для установления конечной точки титрования часто служат индикаторы, большинство которых представляют собой орг соединения.
, а также нитро-, нитрозо-, азо- и имйногрупп в орг. соединениях; раствором N-бромсукцинимида титруют растворы As(III), Sb(III) и др. восстановителей, а гидрохинон служит титрантом для определения окислителей — Au (III), Ce(IV). Реагент Фишера (раствор I2 и SO2 в смеси пиридина и метанола) широко применяют для определения воды. Наиб. часто в качестве титрантов используют комплексоны, особенно динатриевую соль этилендиаминтетрауксусной кислоты (см. комплексонометрия). Для установления конечной точки титрования часто служат индикаторы, большинство которых представляют собой орг соединения.
ОР для экстракции. Экстракцией можно выделять элементы из очень разб. растворов. Для этого элемент переводят в гидрофобное соед., напр., с помощью ОР. В некоторых случаях "активный" экстрагент сам образует экстрагирующееся соед. и сам сольватирует его. В др. случаях экстрагент только растворяет экстрагируемое соед., для образования которого необходимо добавить ОР (купферон, 8-гидроксихино-лин). "Активными" экстрагентами м. б. изоамилацетат, метилэтилкетон, циклогексанон, трибутилфосфат, ди(2-этил-гексил) фосфорная кислота, трифенилфосфин и др. Синтезированы ОР для селективной экстракции элементов, напр. экстрагент БТ-1 (5-амино-4-[2-гидрокси-5-хлорфенил)азо]-2-(2-гидроксифенил)-2H-бензотриазол) для Ca и Sr. В качестве растворителей для экстракции разл. соединений часто используют CHCl3, CCl4, C6H6. Экстрагировать можно и растворимые в воде окрашенные соед. (напр., комплексные соед. мн. металлов с арсеназо III и тороном) в виде ионных ассоциатов. В этих случаях в раствор вводят соль орг. катиона (дифенилгуанидиния, тетрафениларсония и др.) и экстракцию осуществляют полярными растворителями, напр. бутиловым или амиловым спиртом.
ОР в фотометрическом и люминесцентном анализе. Большинство фотометрич. методов основано на образовании окрашенных комплексных соед. ОР с определяемыми элементами, обычно катионами металлов. При этом неокрашенные ОР (напр., 2,2'-дипиридил, сульфосалициловая кислота для Fe) обьгчно более избирательны, но менее чувствительны, чем окрашенные. В последнем случае для улучшения избирательности строго контролируют pH среды, вводят маскирующие агенты. Примерами окрашенных ОР для фо-тометрич. анализа могут служить арсеназо III, пирокатехм-новый фиолетовый, ксиленоловый оранжевый, фосфоназо, широко применяемые для определения Al, Th, суммы РЗЭ и др.
Элементы, образующие комплексные анионы типа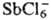 ,
, 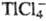
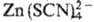 , определяют экстракционно-фотометрич. методом в виде солей с окрашенными орг. катионами. В качестве последних используются метиловый синий, кристаллич. фиолетовый, родамин Б и др.
, определяют экстракционно-фотометрич. методом в виде солей с окрашенными орг. катионами. В качестве последних используются метиловый синий, кристаллич. фиолетовый, родамин Б и др.
Ионы металлов-окислителей, напр. Au (III), Ce (IV), Cr(VI), Mn(VII), V(V), с некоторыми бесцв. ОР (напр., бензидином и его производными) образуют окрашенные продукты окисления, оптич. плотность которых измеряют. Например, для определения Cr(VI) широко применяют высокоизбират. реакцию с дифенилкарбазидом, в результате которой образуется синий продукт с высоким значением ε. Такие окислители, как Cl2, Ce (IV), определяют фотометрически по интенсивности окраски продуктов окисления о-толидина (3,3'-диметилбензи-дин).
Разработаны фотометрич. методы обнаружения и определения соединений с использованием ОР. Например, аминокислоты определяют с помощью нингидрина, винную кислоту — с помощью 4-диметиламинобензальдегида, метиловый спирт — с помощью хромотроповой кислоты.
Люминесцентный анализ основан на образовании некоторыми ОР люминесцирующих комплексных соед. с определяемыми элементами, в частности 8-гидроксихинолина или мори-на с А1, бис-салицилальэтилендиамина с Mn, люмогаллиона [2-гидрокси-5-хлор-3-(2,4-дигидроксифенилазо)бензолсульфокислота] с Ga и Nb. Такие ОР, как люминол и люцигенин, используются для хемилюминесцентного определения Со(II), Fe(II), Mn(II), Pb(II) и др. металлов; с помощью люминола определяют также орг. соединения, напр. нафтолы, аминокислоты, аминофенолы.
Прочие случаи применения ОР. Некоторые орг. вещества служат компонентами буферных растворов, напр. бензойная, D-винная, аминоуксусная (глицин), лимонная и фталевая кислоты, мочевина, уротропин.
Мн. ОР, способные образовывать комплексные соед. с катионами металлов, применяют как маскирующие агенты. К ним относятся, в частности, комплексоны, винная, лимонная, сульфосалицшювая, аскорбиновая кислоты, хлорид триэтаноламмония.
Желатин, поливиниловый спирт служат стабилизаторами разл. суспензий. ОР могут также применяться в качестве активаторов в кинетич. методах анализа, как, напр., пиридин и 2,2'-дипиридил при определении Cu и Fe. В полярографии ОР (лимонная кислота, маннит, иодид тетрабутиламмония) вводят в исследуемые растворы для смещения полярографич. волн.
Иногда используют окислительно-восстановит. свойства ОР. Например, тиомочевиной восстанавливают Mo(VI) и Fe(III) в некоторых методах их определения, ферроценом — Re (VII), Mo(VI), V(V), Ce(IV) и др. элементы при их фотометрич., титриметрич. или амперометрич. определении.
Лит.: Файгль Ф., Капельный анализ органических веществ, пер. с англ., М., 1962; Саввин С. Б., Органические реагенты труппы арсеначо III, М , 1971; Саввин С. Б., Кузин Э.Л., Электронные спектры и структура органических реагентов, М., 1974; Бургер К., Органические реагенты в неорганическом анализе, пер. с англ., М., 1975; Органические реагенты в неорганическом анализе, пер. с чеш., М., 1979; Золотев Ю.А., Кузьмин Н.М., Концентрирование микроэлементов, М., 1982.
С. Б. Саввин
