платина
ПЛАТИНА (исп. platina, уменьшит. от plata — серебро; лат. Platinum) Pl
хим. элемент VIII гр. периодической системы, ат. н. 78, ат. м. 195,08; относится к платиновым металлам. Природная П. состоит из четырех стабильных изотопов: 194Pt (32,9%), 195Pt (33.8%), 196Pt (25,2%), 198Pt (7,2%) и двух радиоактивных-190Pt (0,013%, Т1/2 6,9∙1011 лет), 192Pt (0,78%, T1/2 1015 лет). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 8,8∙10−28 м2. Конфигурация внеш. электронной оболочки атома 5d96s1; степени окисления 0, +2, +3, +4, редко +5, +6; энергия ионизации Pt0 → Pt+ → Pt2+ → Pt3+соотв. 9,0, 18,56 и 23,6 эВ; электроотрицательность по Полингу 2,2; атомный радиус 0,138 нм, ионные радиусы (в скобках даны координац. числа) Pt2+ 0,074 нм (4, квадрат) Pt2+ 0,094 нм (6), Pt4+ 0,077 нм (6), Pt5+ 0,071 нм (6).
П. — один из наиб. редких элементов, его средняя концентрация в земной коре 5∙10−7 % по массе. Встречается в самородном виде, в виде сплавов и соединений. Наиб. важные минералы-самородная П., поликсен (содержит 6–10% Fe), палладистая П. (60–90% П., 7–39% Pd), ферро-платина (12–20% Fe), иридистая П. (55–60% П., до 30% Ir), сперрилит PtAs2, куперит PtS, брэггит (Pt, Pd, Ni)S. Наиб. значит. месторождения П. сосредоточены в ЮАР и СССР (сульфидные руды Норильского района и Кольского п-ова).
Свойства. П. — серовато-белый блестящий пластичный металл; кристаллизуется в гранецентрир. кубич. решетке, а = 0,392 нм, z = 4, пространственная группа Fт3т; т. пл. 1769 °C, т. кип. ок. 3800 °C; плотн. 21,45 г/см3; 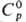 25,85 Дж/(моль∙ К);
25,85 Дж/(моль∙ К); 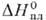 20 кДж/моль,
20 кДж/моль, 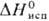 510 кДж/моль;
510 кДж/моль; 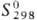 41,6 Дж/(моль∙ К); температ.урный коэф. линейного расширения 9,1∙10−6 К−1 (273–373 К); ρ 9,85 мкОм∙ см (0 °C); теплопроводность 74,1 Вт/(м∙К); парамагнетик, уд. магн. восприимчивость +9,71∙10−7 (20 °C); работа выхода электрона 5,23 эВ. Твердость по Бринеллю 390–420; модуль упругости 173 ГПа, твердость по Виккерсу 38–40. В горячем состоянии П. хорошо прокатывается и сваривается. Холодное деформирование упрочняет П., относительное удлинение уменьшается от 30–50 до 1–2%, а твердость по Виккерсу увеличивается до 90–95. Отжиг П. приводит к восстановлению ее пластичности. Легирующие добавки обычно увеличивают прочность и твердость П.
41,6 Дж/(моль∙ К); температ.урный коэф. линейного расширения 9,1∙10−6 К−1 (273–373 К); ρ 9,85 мкОм∙ см (0 °C); теплопроводность 74,1 Вт/(м∙К); парамагнетик, уд. магн. восприимчивость +9,71∙10−7 (20 °C); работа выхода электрона 5,23 эВ. Твердость по Бринеллю 390–420; модуль упругости 173 ГПа, твердость по Виккерсу 38–40. В горячем состоянии П. хорошо прокатывается и сваривается. Холодное деформирование упрочняет П., относительное удлинение уменьшается от 30–50 до 1–2%, а твердость по Виккерсу увеличивается до 90–95. Отжиг П. приводит к восстановлению ее пластичности. Легирующие добавки обычно увеличивают прочность и твердость П.
По химическим свойствам П. близка к Pd, но несколько превосходит его по хим. устойчивости. При нагр. на воздухе или в атмосфере O2 П. окисляется с образованием летучих оксидов. Один объем платиновой черни поглощает до 100 объемов O2. П. медленно раств. в горячей H2SO4 и жидком Br2, раств. в царской водке. Не взаимод. с другими минер. и орг. кислотами. При нагр. реагирует со щелочами, Na2O2, галогенами, S, Se, Те, P, С, Si. Поглощает H2, хотя в этом отношении уступает Pd, Ir и Ru; удаление поглощенного H2 из П. нагреванием в вакууме затруднено.
С кислородом П. образует красновато-коричневый три-оксид PtO3 (м. б. пероксид), коричневый диоксид PtO2 и черный оксид PtO, разлагающиеся соотв. при комнатной температуре, при 380–400 °C и при 560 °C. PtO3 окисляет HCl до Cl2; получают анодным окислением. PtO2 образует неск. гидратов; получают гидролизом PtCl4. PtO синтезируют окислением порошкообразной П. в O2 или термич. разложением Pt(OH)2, который осаждают из растворов при щелочном гидролизе хлороплатинатов(П). Окислением П. в разл. условиях получены также Pt2O3 и Pt3O4, гидролизом хлоропла-тинатов(IV) — Pt(OH)4.
Гексафторид PtF6 — темно-красные кристаллы; т. пл. 69,4 °C, т. возг. 69 °C; 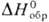 −676 кДж/моль (для газа); сильнейший окислитель, реагирует с Xe, O2 и NO, образуя соотв. XePtF6, O2PtF6, NOPtF6; получают фторированием П. при 950–1000 °C, под давлением — при 200 °C или с использованием атомного фтора. Темно-красный пентафторид PtF5 получают фторированием П. при 350 °C, светло-коричневый тетрафторид PtF4 (разлагается выше 300 °C, плотн. 7,07 г/см3,
−676 кДж/моль (для газа); сильнейший окислитель, реагирует с Xe, O2 и NO, образуя соотв. XePtF6, O2PtF6, NOPtF6; получают фторированием П. при 950–1000 °C, под давлением — при 200 °C или с использованием атомного фтора. Темно-красный пентафторид PtF5 получают фторированием П. при 350 °C, светло-коричневый тетрафторид PtF4 (разлагается выше 300 °C, плотн. 7,07 г/см3, 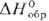 −410 кДж/моль)-фторированием П. при 200 °C. Желтый трифторид состава PtII [PtIVF6] получают в смеси с др. фторидами при фторировании П. Все фториды П. гигроскопичны и разлагаются водой. Известны окси-фториды П. и фтороплатинаты(IV, V и VI).
−410 кДж/моль)-фторированием П. при 200 °C. Желтый трифторид состава PtII [PtIVF6] получают в смеси с др. фторидами при фторировании П. Все фториды П. гигроскопичны и разлагаются водой. Известны окси-фториды П. и фтороплатинаты(IV, V и VI).
Красновато-коричневый тетрахлорид PtCl4 разлагается при 370 °C даже в атмосфере Cl2; образует гидраты с 1, 4, 5 и 7 молекулами воды и платинохлористоводородные кислоты (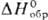 PtCl4∙5H2O −1748 кДж/моль, H[PtCl5]∙ 2H2O −1013 кДж/моль, H2[PtCl6]∙ 6H2O −2363 кДж/моль); хорошо раств. в воде и ацетоне; получают хлорированием П. при 250–300 °C, разложением H2PtCl6 ∙ 6H2O при 300 °C. Диxлорид PtCl 2 (
PtCl4∙5H2O −1748 кДж/моль, H[PtCl5]∙ 2H2O −1013 кДж/моль, H2[PtCl6]∙ 6H2O −2363 кДж/моль); хорошо раств. в воде и ацетоне; получают хлорированием П. при 250–300 °C, разложением H2PtCl6 ∙ 6H2O при 300 °C. Диxлорид PtCl 2 (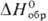 −107 к Дж/моль) существует в двух формах — нерастворимой в воде оливково-зеленой (a) и красноватой (β); разлагается при 580 °C в атмосфере Cl2; при растворении в слабой соляной кислоте образует H2[PtCl4], в водных растворах NH3-аммин [Pt(NH3)2Cl2]. Известны также аддукты типа PtCl2∙ 2PCl3 (т. пл. 160 °C), PtCl2∙ 2PF3 (т. пл. 102 °C); получают PtCl2 хлорированием П. выше 500 °C, разложением H2[PtCl6]∙ 6H2O при 360–380 °C. Существуют многочисленные хлороплатинаты(IV и II): MI2[PtCl6] и MI2[PtCl4], напр. гексахлорплатинат (IV) аммония (NH4)2 [PtCl6 ] — желтые кристаллы;
−107 к Дж/моль) существует в двух формах — нерастворимой в воде оливково-зеленой (a) и красноватой (β); разлагается при 580 °C в атмосфере Cl2; при растворении в слабой соляной кислоте образует H2[PtCl4], в водных растворах NH3-аммин [Pt(NH3)2Cl2]. Известны также аддукты типа PtCl2∙ 2PCl3 (т. пл. 160 °C), PtCl2∙ 2PF3 (т. пл. 102 °C); получают PtCl2 хлорированием П. выше 500 °C, разложением H2[PtCl6]∙ 6H2O при 360–380 °C. Существуют многочисленные хлороплатинаты(IV и II): MI2[PtCl6] и MI2[PtCl4], напр. гексахлорплатинат (IV) аммония (NH4)2 [PtCl6 ] — желтые кристаллы; 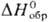 −984,1 кДж/моль; плохо раств. в воде, разлагается при нагр. до металла.
−984,1 кДж/моль; плохо раств. в воде, разлагается при нагр. до металла.
Коричневато-черный тетрабромид PtBr4 (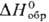 −159 кДж/моль) медленно разлагается при 180 °C; его получают из простых веществ при 150 °C или выпариванием раствора П. в смеси HNO3 и HBr. Коричневый дибромид PtBr2 (
−159 кДж/моль) медленно разлагается при 180 °C; его получают из простых веществ при 150 °C или выпариванием раствора П. в смеси HNO3 и HBr. Коричневый дибромид PtBr2 (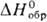 −100 кДж/моль) разлагается при 250 °C. Коричневато-черный тетраиодид PtI4 (
−100 кДж/моль) разлагается при 250 °C. Коричневато-черный тетраиодид PtI4 (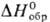 — 59,4 к Дж/моль) разлагается при 130 °C; его получают из простых веществ или осаждают действием KI на раствор H2PtCl6. Черный дииодид PtI2 разлагается при 360 °C.
— 59,4 к Дж/моль) разлагается при 130 °C; его получают из простых веществ или осаждают действием KI на раствор H2PtCl6. Черный дииодид PtI2 разлагается при 360 °C.
Серовато-черные сульфид PtS (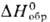 −83,09 кДж/моль) и дисульфид PtS2 (
−83,09 кДж/моль) и дисульфид PtS2 (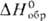 −112 кДж/моль, разлагается при 225–250 °C) не раств. в воде и м. б. получены взаимод. П. с S, дисульфид — также осаждением H2S из растворов гексахлороплатинатов(IV). Близкими свойствами обладают селенид PtSe2 и теллуриды PtTe и PtTe2.
−112 кДж/моль, разлагается при 225–250 °C) не раств. в воде и м. б. получены взаимод. П. с S, дисульфид — также осаждением H2S из растворов гексахлороплатинатов(IV). Близкими свойствами обладают селенид PtSe2 и теллуриды PtTe и PtTe2.
Сульфаты П. легко гидролизуются, в присутствии хлорид-ионов легко переходят в хлориды и хлороплатинаты.
П. в степени окисления +2 и +4 образует многочисл. комплексные соед., по составу близкие к соед. Pd. Наиб. многочисленны соед. [PtX4]2− и [PtX6]2− (X = F, Cl, Br, I). Получены комплексные соед. Pt0, напр. Pt(PF3)4 (т. пл. 15 °C, т. кип. ок. 87 °C). Известны также разл. аммины, разно-лигандные комплексы, соед. с орг. лигандами, моно- и полиядерные комплексы и т. д.
• см. также платинаорганические соединения
Получение. Шлиховую П., лом или концентраты платиновых металлов растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3 и восстановления иридия и палладия до Ir3+ и Pd2+. Далее осаждают (NH4)2PtCl6 действием NH4Cl, осадок высушивают и прокаливают при постепенном повышении температуры до 800–1000 °C с получением загрязненной губчатой П. Чистую П. получают растворением этого продукта в царской водке, повторным осаждением и прокаливанием. Губчатую П. переплавляют. При восстановлении солей П. в растворах образуется мелкодисперсная П. — платиновая чернь. Для получения платиновых покрытий (платинирование) используют фосфатные или цис-диамминонитритные электролиты.
Применение. Осн. области применения П., ее сплавов и соед. — автомобилестроение (в развитых странах потребляется от 30 до 65% П.), электротехника и электроника (7–13%), нефтехимия и орг. синтез (7–12%), стекольная и керамич. промышленность (3–17%), производство ювелирных изделий (2–35%). Применение катализаторов дожигания выхлопных газов автомобилей [сплав Pt-Pd (70–30%)] началось в сер. 70-х гг. и быстро расширялось в связи с ужесточением требований к охране атм. воздуха. В электротехнике и электронике П. используют как материал контактов электрич. приборов и печей сопротивления. Так, для контактов высоковольтных реле применяют сплавы П. с Ir и Ru. П. и ее сплавы с Ir и Re в нефтехимии применяют для повышения октанового числа бензина, в орг. синтезе-как катализаторы гидрирования, изомеризации, циклизации, окисления. С помощью таких катализаторов производят, напр., бензол, толуол, ксилол.
П. используют для каталитич. синтеза HNO3, H2SO4, ката-литич. очистки H2. Платиновые катализаторы используют в виде сеток, черней и нанесенными на носители.
В стекольной промышленности П. с добавками Rh и Ir-осн. конструкц. материал стекловаренных печей для производства оптич. стекла. Из сплавов с Rh и Au изготовляют фильеры для получения стекловолокна, а также футеровку для печей, краски для керамики и стекла. П. применяют в качестве материала высокотемпературных термопар и термометров сопротивления, электродов при электролизе, для изготовления лаб. посуды и оборудования, в зубоврачебном деле. Сравнительно новые области применения П. — изготовление катализаторов для топливных элементов, создание противоопухолевых препаратов [цис-Pt(NH3)2Cl2], производство контейнеров для радиоизотопных генераторов.
В сер. 80-х гг. ежегодная добыча П. в капиталистич. и развивающихся странах составляла 60–75 т, а извлечение из вторичных источников-ок. 5–10 т.
Лит.: Платина, ее сплавы и композиционные материалы, М., 1980. См. также лит. при ст. платиновые металлы.
Значения в других словарях
- Платина — (лат. Platinum) Pt, химический элемент VIII группы периодической системы Менделеева, атомный номер 78, атомная масса 195,09; тяжёлый тугоплавкий металл. О П., а также о рутении, родии, палладии, осмии и иридии, сопутствующих... Большая советская энциклопедия
- платина — -ы, ж. Химический элемент, благородный металл серовато-белого цвета, обладающий большой ковкостью и тягучестью (употребляется в электро- и радиотехнике, ювелирном деле и т. д.). В толстом кольце из платины горел злым зеленым огнем изумруд. М. Горький, Жизнь Клима Самгина. [исп. platina] Малый академический словарь
- ПЛАТИНА — (Platina), Бартоломео Сакки (Sacchi) (1421 — 21.IX.1481), — итал. гуманист, историк. Чл. Рим. академии — кружка гуманистов. Обвиненный в заговоре против папы Павла II, подвергался аресту в 1464 и 1468. Наиболее значит. его соч. — сб. Советская историческая энциклопедия
- платина — Пла́тин/а. Морфемно-орфографический словарь
- платина — орф. платина, -ы Орфографический словарь Лопатина
- платина — ПЛАТИНА ы, ж. platine f. текст. Металлическая пластинка; плоская часть разных инструментов; зажим, крючок, проступной крючок. Сл. 1948. Платины — тонкие стальные пластинки фигурной формы, расположенные между иглами. Словарь галлицизмов русского языка
- платина — платина , -ы Орфографический словарь. Одно Н или два?
- платина — Заимств. в XIX в. из франц. яз., где platine < исп. platina, суф. уменьшит.-ласкат. производного от plata «серебро». Этимологический словарь Шанского
- ПЛАТИНА — ПЛАТИНА (символ Pt), блестящий серебристо-белый ПЕРЕХОДНЫЙ ЭЛЕМЕНТ, металл, открытый в 1735 г. Встречается, главным образом, в некоторых никелевых рудах. Научно-технический словарь
- Платина — Pt (исп. platina, уменьшит. от plata — серебро * а. platinum; н. Platin; ф. platine; и. platino), — хим. элемент VIII группы периодич. системы Mенделеева, ат. н. 78, ат. м. 195,09. П. первый в группе платиновых металлов. Горная энциклопедия
- платина — ПЛАТИНА -ы; ж. [исп. platina] Химический элемент (Pt), благородный металл серебристо-белого цвета, обладающий красивым внешним видом, химической стойкостью и тугоплавкостью (применяется в электро- и радиотехнике, ювелирном деле... Толковый словарь Кузнецова
- платина — Платины, мн. нет, ж. [исп. platina, уменьш. к plata – серебро]. Драгоценный нержавеющий металл белого цвета, ценимый дороже золота. Большой словарь иностранных слов
- платина — ПЛ’АТИНА, платины, мн. нет, ·жен. (исп. platina, уменьш. к plata — серебро). Драгоценный нержавеющий металл белого цвета, ценимый дороже золота. Самородная платина. Чистая платина. Губчатая платина (см. губчатый). Толковый словарь Ушакова
- Платина — Бартоломео де'Сакки (Platina, 1421—1481) — итальянский гуманист, родом из Пьядены (по-латыни Platina, отсюда и его прозвище) близ Кремоны, был одно время солдатом у Сфорцы, потом жил в Мантуе и Флоренции... Энциклопедический словарь Брокгауза и Ефрона
- платина — Это слово было заимствовано из французского, где существительное platine является уменьшительным к plata – "серебро". Этимологический словарь Крылова
- ПЛАТИНА — ПЛАТИНА (лат. Platinum) — Pt, химический элемент VIII группы периодической системы, атомный номер 78, атомная масса 195,08, относится к платиновым металлам. Название от исп. platina (уменьшительное от plata — серебро). Плотность 21,45 г/см3, tпл 1769 °С. Большой энциклопедический словарь
- платина — пла́тина Через нем. Platina или прямо из исп. platina – то же, производного от исп. рlаtа "серебро" (Преобр. II, 69; Клюге-Гётце 449). Этимологический словарь Макса Фасмера
- платина — платина ж. Благородный драгоценный металл серебристо-белого цвета, ценимый дороже золота. Толковый словарь Ефремовой
- платина — ПЛАТИНА, платина ж. белое золото, самородный (не рудный) ценный металл, тяжелее золота, весьма твердый и огнестойкий. Платинный и платиновый, из нее сделанный, к ней относящ. Платинистый осмий, иридий, содержащий в себе платину. Платинка... Толковый словарь Даля
- платина — ПЛАТИНА, ы, ж. Драгоценный тугоплавкий блестящий металл серовато-белого цвета. | прил. платиновый, ая, ое. Платиновая брошь. Платиновая руда. Металлы платиновой группы. Толковый словарь Ожегова
