палладийорганические соединения
ПАЛЛАДИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
содержат связь Pd—С. Связь Pd с орг. лигандом может осуществляться по 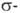 и
и 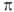 -типу (соотв.
-типу (соотв. 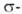 и
и 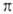 -комплексы). Формальная степень окисления Pd в П. с. преим. +2, реже 0 и в некоторых биядерных комплексах +1. Физ. и хим. свойства П. с. зависят от типа П. с., степени окисления Pd и присутствия др. лигандов.
-комплексы). Формальная степень окисления Pd в П. с. преим. +2, реже 0 и в некоторых биядерных комплексах +1. Физ. и хим. свойства П. с. зависят от типа П. с., степени окисления Pd и присутствия др. лигандов.
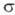 -Комплексы. Для соед. Pd с
-Комплексы. Для соед. Pd с 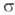 -связью Pd—С характерны комплексы [PdX(R)L2] и [Pd(R2)L2] (R-Alk, Ar, алкенил, ацил, алкинил; L-донорный лиганд, преим. третичный фосфин; Х-Cl, Br и др.), молекулы которых имеют строение плоского квадрата. Осн. хим. реакции а-комплсксов: 1) термич. разложение соед. типа [Pd(R2)L2] (R = CH3, C2H5, C3H7) с образованием углеводородов R—R или олефинов (при R
-связью Pd—С характерны комплексы [PdX(R)L2] и [Pd(R2)L2] (R-Alk, Ar, алкенил, ацил, алкинил; L-донорный лиганд, преим. третичный фосфин; Х-Cl, Br и др.), молекулы которых имеют строение плоского квадрата. Осн. хим. реакции а-комплсксов: 1) термич. разложение соед. типа [Pd(R2)L2] (R = CH3, C2H5, C3H7) с образованием углеводородов R—R или олефинов (при R CH3); 2) расщепление связи Pd—С при действии кислот, галогенов, окислителей, комплексных гидридов металлов; 3) реакции внедрения лигандов по связи Pd—С (важны в каталитич. реакциях образования связи C—C); 4) легкое замещение лигандов X, находящихся в транс-положении к R в П.с. типа [PdX(R)L2], напр.:
CH3); 2) расщепление связи Pd—С при действии кислот, галогенов, окислителей, комплексных гидридов металлов; 3) реакции внедрения лигандов по связи Pd—С (важны в каталитич. реакциях образования связи C—C); 4) легкое замещение лигандов X, находящихся в транс-положении к R в П.с. типа [PdX(R)L2], напр.:
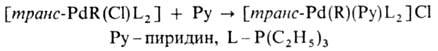
Способы получения s-комплексов: 1) взаимод. солей и комплексов Pd с орг. соед. металлов (Mg, Li, Hg, Al, Tl и др.), напр.:
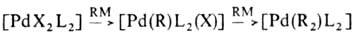
2) окисли. присоединение орг. галогенидов к комплексам Pd(0): [PdL4] + RX → [PdX(R)L2]; 3) взаимод. комплексов Pd(0) с соед., содержащими поляризованную связь C=Y (Y = О, S), напр.:
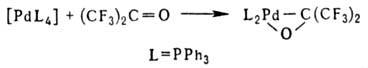
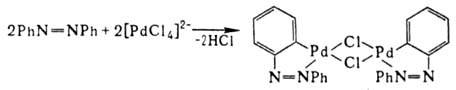
3) особый случай образования  -связи Pd—С — реакции циклометаллирования, напр.:
-связи Pd—С — реакции циклометаллирования, напр.:
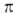 -Комплексы. Наиб. многочисленны и хорошо изучены
-Комплексы. Наиб. многочисленны и хорошо изучены 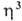 -аллильные комплексы, которые обладают относит, устойчивостью и доступностью. Большинство комплексов относят к димерам типа [PdCl(
-аллильные комплексы, которые обладают относит, устойчивостью и доступностью. Большинство комплексов относят к димерам типа [PdCl(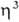 -аллил)]2 с
-аллил)]2 с 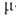 -галогеновыми мостиками. Основные хим. реакции комплексов: 1) обмен атома Cl на др. лиганды; реакции могут протекать с сохранением димерной структуры (напр., при замене на Br или I) или с разрывом галогеновых мостиков (напр., при действии циклопентадиенидов и ацетилацетонатов Na или Tl, фосфинов и др. подобных реагентов); в последнем случае образуются мономерные комплексы [Pd(
-галогеновыми мостиками. Основные хим. реакции комплексов: 1) обмен атома Cl на др. лиганды; реакции могут протекать с сохранением димерной структуры (напр., при замене на Br или I) или с разрывом галогеновых мостиков (напр., при действии циклопентадиенидов и ацетилацетонатов Na или Tl, фосфинов и др. подобных реагентов); в последнем случае образуются мономерные комплексы [Pd(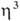 -аллил) (
-аллил) (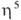 -C5H5)], [Pd(
-C5H5)], [Pd(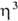 -аллил) асас](асас — ацетилацетонат анион); 2) разрыв связи Pd—аллил при окислении с образованием ненасыщ. карбонильных соед., при восстановлении с образованием моноолефинов и насыщ. соед., а также при действии галогенов, оснований и др.; 3) реакции переноса аллильного лиганда на др. металлы, напр.:
-аллил) асас](асас — ацетилацетонат анион); 2) разрыв связи Pd—аллил при окислении с образованием ненасыщ. карбонильных соед., при восстановлении с образованием моноолефинов и насыщ. соед., а также при действии галогенов, оснований и др.; 3) реакции переноса аллильного лиганда на др. металлы, напр.:
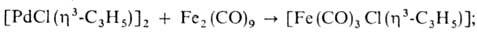
4) в присутствии донорных лигандов или при повышенной температуре мн. аллильные комплексы Pd претерпевают динамич. перегруппировки, включающие 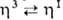 — переходы аллильного ли-ганда.
— переходы аллильного ли-ганда.
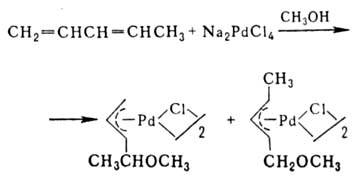
Способы получения  -аллильных комплексов: 1) реакции олефинов с PdCl2 или Na2PdCl4 в уксусной кислоте разл. концентрации, иногда в присутствии оснований, промежуточно образуются
-аллильных комплексов: 1) реакции олефинов с PdCl2 или Na2PdCl4 в уксусной кислоте разл. концентрации, иногда в присутствии оснований, промежуточно образуются  -олефиновые комплексы (см. ниже); побочные продукты — насыщ. и ненасыщ. альдегиды и кетоны; 2) взаимод. соед. Pd(II) с 1,3- и 1,2-диенами, замещенными циклопропанами, аллилгалогснидами и родственными соед., с аллильными соед. др. металлов и т. п., напр.:
-олефиновые комплексы (см. ниже); побочные продукты — насыщ. и ненасыщ. альдегиды и кетоны; 2) взаимод. соед. Pd(II) с 1,3- и 1,2-диенами, замещенными циклопропанами, аллилгалогснидами и родственными соед., с аллильными соед. др. металлов и т. п., напр.:
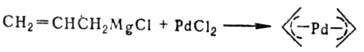
h2-Олефиновые комплексы известны для Pd(II) типа [PdCl2(h2 — олефин)]2 и Pd(0) типа [РdL2(h2-олефин)], где L = PPh3. Комплексы Pd(II) присоединяют нуклеофилы к олефиновому лиганду с восстановлением Pd(II) до Pd(0), напр.:
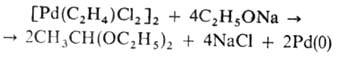
Подобные реакции лежат в основе пром. способов получения винилацетата и ацетальдегида из этилена. Получают олефиновые комплексы Pd(II) замещением на олефины др. лигандов, напр.: [PdCl2(NCPh)2] + олефин → [PdCl2(h2-олефин)]2, а также прямым взаимод. PdCl2 с олефинами, напр. с изобутеном, стиролом, циклогексеном и др. Образующиеся h2-олефиновые комплексы обычно неустойчивы и в зависимости от строения олефина и условий реакции превращ. в h3-аллильные комплексы с отщеплением HCl или дают продукты окисления олефинов (альдегиды или кетоны) при взаимодействии с водой. h2-Олефиновые комплексы Pd(0) получены с олефинами, имеющими электроноакцепторные заместители, напр. с производными малеиновой и фумаровой кислот, 1,4-бензохиноном и др. h2-Олефиновые комплексы Pd(0) с дибензилиденацетоном (DBA) типа [Pd(DBA)3] или [Pd2(DBA)3] используют для синтеза различных П. с.
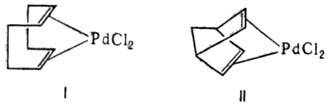
Из h2-диеновых комплексов Pd устойчивы соед. с 1,4- и особенно 1,5-диенами, напр. с 1,5-циклооктадиеном (формула I), дициклопентадиеном, норборнадиеном (формула II):
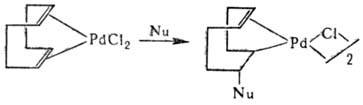
1,3-Диены образуют с соед. Pd(II) h2-олефиновые комплексы, которые затем перегруппировываются в h3-аллильные. Комплексы с 1,5-диенами обратимо присоединяют нуклеофилы (Nu), гл. обр. RO− и CH3COO−, b-дикетонат-анионы с образованием хелатных s, p-комплексов:
Фосфины, пиридин, диметилсульфоксид и др. мягкие основания вытесняют диеновые лиганды из комплексов Pd, напр.: [PdCl2(h4-C8H12 + (CH3)2SO → C8H12 + [PdCl2{(CH3)2 SO}2]. Получают h4 — диеновые комплексы Pd непосредственным взаимод. диенов с Na2PdCl4 или замещением на диен др. лигандов в комплексах Pd.
Циклобутадиеновые комплексы Pd получают взаимод. замещенных ацетиленов с комплексами Pd обычно с послед, обработкой HHal:
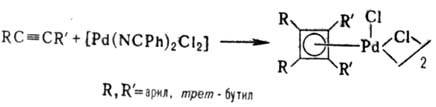
Циклобутадиеновый лиганд легко переносится с Pd на др. металлы (Mo, W, Fe, Co, Ni и др.).
Моноциклопентадиенильные комплексы Pd содержат в качестве др. лигандов фосфины, галогены, h3-аллильную группу и т. д. h5-C5H5-лиганд легко отщепляется при действии разл. реагентов, напр.:
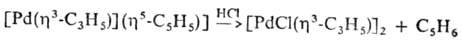
Получают их взаимод. соед. Pd с циклопентадиенидами металлов МC5H5 (М = Na, К, Li, Те):
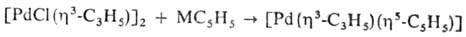
h2-Ацетиленовые комплексы Pd(0) типа [Pd(RC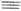 CR) (PPh3)2] устойчивы, когда R-электроноакцепторные группы (CF3, COOCH3). Они образуются при реакциях [Pd(PPh3)4] с RC
CR) (PPh3)2] устойчивы, когда R-электроноакцепторные группы (CF3, COOCH3). Они образуются при реакциях [Pd(PPh3)4] с RC CR. Взаимод. [PdCl2(h2 -C2H4]2 или [Pd(NCPh)2Cl2] с RC
CR. Взаимод. [PdCl2(h2 -C2H4]2 или [Pd(NCPh)2Cl2] с RC CR (R = трет-C4H9)приводит к ацетиленовому комплексу Pd(II) [PdCl2(h2-RC≡CR)]2. При реакциях с др. ацетиленами соед. Pd(II) дают h3-аллильные комплексы или продукты ди-, три- и олигомеризации ацетиленов.
CR (R = трет-C4H9)приводит к ацетиленовому комплексу Pd(II) [PdCl2(h2-RC≡CR)]2. При реакциях с др. ацетиленами соед. Pd(II) дают h3-аллильные комплексы или продукты ди-, три- и олигомеризации ацетиленов.
Известны также карбеновые комплексы Pd, которые образуются при присоединении спиртов и аминов к изонитрильным комплексам:
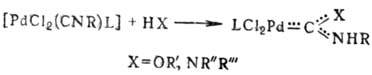
П, с,-важные промежут. продукты во мн. орг. реакциях, катализируемых соед. Pd. К ним относят окисление олефинов, олигомеризацию олефинов, диенов и ацетиленов, карбонилирование, винилирование, ацетоксилирование, изомеризацию и др. П. с. используют в орг. синтезе для образования связей C—O, С—Hal, С—N, С—S, С—Si. Некоторые П. с. — эффективные катализаторы, напр., при карбонилировании аллилгалогенидов (аллильные комплексы), при линейной димеризации и тримеризации бутадиена, ацетилировании олефинов и аллена.
Лит.: Методы элементоорганической химии. Кобальт, никель, платиновые металлы, под ред. А. Н. Несмеянова, К. А. Кочешкова, М., 1978, с. 566–626; Comprehensive organometallic chemistry, ed. by G. Wilkinson, F. G. A. Stone, E.W. Abel, v. 6, N.Y., 1982, p. 243–469.
Л. В. Рыбин
