обратимые и необратимые процессы
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
пути изменения состояния термодинамич. системы. Процесс наз. обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежут. состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс — идеализир. случай, достижимый лишь при бесконечно медленном изменении термодинамич. параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы наз. необратимым.
Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия, теплопроводность, вязкое течение и др. Для хим. реакции применяют понятия термодинамич. и кинетич. обратимости, которые совпадают только в непосредств. близости к состоянию равновесия. Реакция А + В ⇄ C + D наз. кинетически обратимой или двусторонней, если в данных условиях продукты С и D могут реагировать друг с другом с образованием исходных веществ А и В. При этом скорости прямой и обратной реакций, соотв.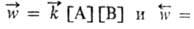
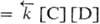 , где
, где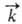 и
и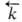 -константы скорости, [А], [В], [С], [D]- текущие концентрации (активности), с течением времени становятся равными и наступает химическое равновесие, в котором
-константы скорости, [А], [В], [С], [D]- текущие концентрации (активности), с течением времени становятся равными и наступает химическое равновесие, в котором 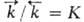 -константа равновесия., зависящая от температуры. Кинетически необратимыми (односторонними) являются обычно такие реакции, в ходе которых хотя бы один из продуктов удаляется из зоны реакции (выпадает в осадок, улетучивается или выделяется в виде малодиссоциированного соед.), а также реакции, сопровождающиеся выделением большого количества тепла.
-константа равновесия., зависящая от температуры. Кинетически необратимыми (односторонними) являются обычно такие реакции, в ходе которых хотя бы один из продуктов удаляется из зоны реакции (выпадает в осадок, улетучивается или выделяется в виде малодиссоциированного соед.), а также реакции, сопровождающиеся выделением большого количества тепла.
На практике нередко встречаются системы, находящиеся в частичном равновесии, т. е. в равновесии по отношению к определенного рода процессам, тогда как в целом система неравновесна. Например, образец закаленной стали обладает пространств. неоднородностью и является системой, неравновесной по отношению к диффузионным процессам, однако в этом образце могут происходить равновесные циклы мех. деформации, поскольку времена релаксации диффузии и деформации в твердых телах отличаются на десятки порядков. Следовательно, процессы с относительно большим временем релаксации являются кинетически заторможенными и могут не приниматься во внимание при термодинамич. анализе более быстрых процессов.
Необратимые процессы сопровождаются диссипатив-ными эффектами, сущностью которых является производство (генерирование) энтропии в системе в результате протекания рассматриваемого процесса. Простейшее выражение закона диссипации имеет вид:
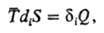
где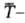 средняя температура, diS-производство энтропии,
средняя температура, diS-производство энтропии, 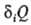 — т. наз. нескомпенсированная теплота Клаузиуса (теплота диссипации).
— т. наз. нескомпенсированная теплота Клаузиуса (теплота диссипации).
Обратимые процессы, будучи идеализированными, не сопровождаются диссипативными эффектами. Микроско-пич. теория О. и н. п. развивается в статистической термодинамике. Системы, в которых протекают необратимые процессы, изучает термодинамика необратимых процессов.
Лит. см. при ст. химическая термодинамика.
Е. П. Агеее
