нитротолуолы
НИТРОТОЛУОЛЫ
соед. общей формулы CH3C6H5-n(NO2)n. Наиб. изучены мононитротолуолы формулы I, мол. м. 137,14. 2- и 3-Н. (при 20 °C)-светло-желтые жидкости, 4-Н. — бесцв. или светло-желтые кристаллы (табл. 1); 2-Н. существует в метастабильной (a) и стабильной (b) модификациях. Все изомеры хорошо раств. в этаноле, диэтиловом эфире, бензоле, ацетоне; растворимость в воде (при 30 °C): 2-Н. 0,0652%, 3-Н. 0,0498%, 4-Н. 0,0442%. Окисление соед. формулы I под действием KMnO4, K2Cr2O7 или MnO2 в кислой среде, а также K3[Fe(CN)6] в щелочной среде приводит к соответствующим нитробензойным кислотам, электрохим. окисление (в CH3COOH или H2SO4) — к нитробензальдегидам. При кипячении с раствором KOH 2-Н. диспропорционирует до 2-аминобензойной (антраниловой) кислоты. Восстановление металлами в кислой среде (для 3-Н. также в нейтральной и щелочной средах) приводит к толуидинам; действие Fe или Zn в щелочной среде — к азо-, азокси- и гидразосоединениям. Хлорирование под действием Cl2 протекает в ядро и в боковую цепь; так, из 4-Н. в условиях радикального процесса образуются 4-нитробензилхлорид, а в присутствии FeCl3 или SbCl3-4-нитро-2-хлортолуол. При хлорировании 2-Н., кроме того, наблюдается замещение группы NO2 на атом хлора с образованием смеси 2-хлортолуола и 2-хлорбензилхлорида. При сульфировании 4-Н. превращ. в 2-метил-5-нитро-бензолсульфокислоту, при нагр. с KOH в спирте — в 4,4'-ди-нитростильбен.
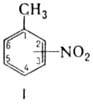
Табл. 1 — СВОЙСТВА МОНОНИТРОТОЛУОЛОВ
При нитровании смесью HNO3 и H2SO4 мононитротолуолы последовательно превращ. в динитротолуолы (мол. м. 182,14; табл. 2) и тринитротолуол. Из 2-Н. образу
ется смесь 2,4- и 2,6-динитроизомеров, из 3-Н.-2,4-динитро-толуол, из 3-Н.-3,4-динитротолуол с небольшими примесями 2,3-, 2,5- и 3,5-изомеров.
Табл. 2 — НЕКОТОРЫЕ СВОЙСТВА ДИНИТРОТОЛУОЛОВ

2,6-Динитротолуол существует в стабильной (a) и двух нестабильных (b) модификациях. Все динитротолуолы хорошо раств. в ацетоне, бензоле, умеренно — в этаноле и диэтиловом эфире, плохо — в воде.
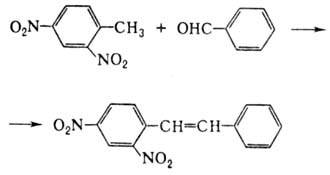
Хим. свойства динитропроизводных обусловлены влиянием двух нитрогрупп на метильную группу, вследствие чего последняя способна замещать атомы Н на др. группы, напр. при взаимодействии с бензальдегидом:
Под действием щелочи динитротолуолы (особенно в присутствии окисляющих агентов, напр. NaClO или O2 воздуха) образуют производные стильбена.
Ди- и тринитротолуолы с ароматическими углеводородами и аминами образуют мол. комплексы с переносом заряда обычно состава 1:1. Устойчивость таких комплексов возрастает с увеличением числа групп NO2 в молекуле.
Др. тип комплексов — анионные s-комплексы (т. наз. комплексы Майзенхаймера) — образуется при взаимодействии ди- и три-нитротолуолов с нуклеофилами OH−, OCH−3, N−3, CN− или алифатич. аминами.
В промышленности Н. получают гл. обр. жидкофазным нитрованием толуола нитрующей смесью (55–66% H2SO4, 28–32% HNO3 и 12–20% H2O) по непрерывной технологии. Для увеличения выхода 4-Н. и во избежание побочной реакции окисления продуктов процесс проводят при 25 °C в присутствии H3PO4, безводного CaSO4 или бензол-1,3-дисульфокислоты. Реакция протекает на поверхности раздела фаз и поэтому требует энергичного перемешивания реагентов; после добавления нитрующей смеси температуру повышают до 35–40 °C. Газофазное нитрование толуола под действием HNO3 проводят при 100–140 °C в присутствии катализатора (5%-ный раствор H2SO4, нанесенный на SiO2 или Al2O3).
Техн. продукт жидкофазного нитрования содержит обычно 55–60% 2-Н., 3–4% 3-Н. и 35–40% 4-Н., которые выделяют после отгонки с паром избытка толуола и высушивании остатка, вымораживая 4-Н. и разделяя 2- и 3-Н. перегонкой в вакууме. В продуктах газофазного нитрования соотношение 4- и 2-изомеров составляет 1,84; конверсия толуола 61%.
Техн. динитротолуол, получающийся нитрованием техн. мононитротолуола нитрующей смесью при 70–80 °C, состоит гл. обр. из 2,4- и 2,6-изомеров (соотв. 75 и 20%): кристаллы желтого цвета, т. пл. 50–54 °C, плотн. 1,32 г/см3 (71 °C); используется без разделения изомеров для получения тринитротолуола.
2-Н. м. б. получен также из 2,4-динитробензола при его обработке (NH4)2S с послед. диазотированием и кипячением с этанолом, З-Н. — ацетилированием n-толуидина с послед. нитрованием, диазотированием и кипячением с этанолом.
Методы анализа Н. основаны на колориметрич. определении окрашенных растворов смеси Н. в H2SO4. По поглощению в областях 436 и 305 нм определяют соотв. 2-Н. и 4-Н. Др. метод анализа Н. — восстановление их до соответствующих толуидинов и определение последних фотометрически.
Н. токсичны, всасываются через кожу, окисляют гемоглобин крови в метгемоглобин, вызывают анемию, отрицательно влияют на центр. нервную систему, функцию почек и печени. Для всех мононитротолуолов ПДК 3 мг/м3, ЛД50 1,46–1,68 г/кг (мыши, перорально); для динитротолуолов ПДК 1 мг/м3, ЛД50 0,5–0,8 г/кг (мыши, перорально).
Н. применяют в синтезе толуидинов, хлорнитротолуолов, нитротолуолсульфокислот, нитротолуолсульфохлоридов, основных красителей (2- и 4-Н.), 4-нитробензойной кислоты (4-Н.), в производстве гербицидов и каучуков. 2-Н. — реагент для обнаружения и фотометрич. определения разл. окислителей [Cl2, N03−, NO−2, Au(III), Cr(VI), Cu(II), Cu(III)], а также HCN в воздухе.
Лит. см. при ст. нитросоединения.
В. И. Ерашко
Значения в других словарях
- Нитротолуолы — Продукты замещения атомов водорода в ядре Толуола СбН5СН3 нитрогруппами —NO2. Техническое значение имеют Н., приведённые в таблице. Большая советская энциклопедия
- Нитротолуолы — Моно-Н., СН3С6Н4NO2, известен во всех трех изомерных формах. Орто- и пара-Н. получаются в смеси при нитровании толуола и разделяются фракционированной перегонкой. Нитрование при 550 дает выход пара-Н. в 5,5 раз больший, чем орто-Н. Энциклопедический словарь Брокгауза и Ефрона
