металлоцены
МЕТАЛЛОЦЕНЫ
дициклопентадиенильные соед. переходных металлов общей формулы (h-C5H5)2М. Получены для большинства d-элементов. Имеют структуру "сэндвича" — металл в степени окисления + 2 располагается между двумя лежащими в параллельных плоскостях циклопентодиенильными кольцами на равном расстоянии от всех атомов С. В большинстве М. связь металла с лигандами ковалентна; исключение — манганоцен, в котором свявь обусловлена электростатич. взаимод. катиона Mn2+ с анионами C5H−5. Частично ионный характер имеют также хромоцен и ванадоцен. В кристаллич. состоянии ферроцен находится в заторможенной антипризматич. или призматич. конформации, рутеноцен и осмоцен — в призматической (формула I).
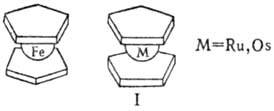
М. — интенсивно окрашенные кристаллы, хорошо раств. в органических растворителях, возгоняются. Соед., имеющие у иона металла оболочку благородного газа (ферроцен, рутеноцен и осмоцен), устойчивы на воздухе, выдерживают нагревание выше 400 °C. Такие М. проявляют ароматич. свойства, в частности атом водорода замещается при действии электроф. реагентов (сульфирование, ацилирование по Фриделю — Крафтсу, меркурирование, металлирование и др.). Ограниченно устойчив никелоцен. Остальные М. очень быстро разрушаются на воздухе. С акцепторами электронов, напр. n-хлоранилом, тетрацианоэтиленом, М. образуют комплексы с переносом заряда. Большинство М. окисляется до металлоцениевых катионов [(C5H5)2М]+ или [(C5H5)2М]2+ , которые существуют обычно в кислых водных растворах, осаждаются в виде солей с комплексными анионами -PFe−6, BF−4, PtCl2−6, Ph4B− и др. Ионы кобальтоцения, родоцения и иридоцения исключительно устойчивы к действию окислителей — не разрушаются при нагр. с конц. HNO3 и царской водкой.
Никелоцен легко обменивает циклопентадиенильные кольца на др. лиганды при действии разнообразных реагентов -Ni(CO)4, NO, PPh3, KCN в жидком аммиаке, CH2=CHCH2MgX, HC≡CH и др. Непредельные соед. (CH3OОСC≡CCOOCH3, CF2≡CF2 и др.) присоединяются к одному кольцу никелоцена с образованием нового ли-ганда, имеющего иной характер связи с Ni.
Кобальтоцен медленно реагирует с водой с выделением H2 и образованием [(C5H5)2Со] +. При действии на него галогенсодержащих орг. соед. (CCl4, CH3I, PhCH2Cl и др.) образуются соль кобальтоцения и нейтральные устойчивые комплексы, напр. p-C5H5CoC5H5CCl3 при реакции с CCl4.
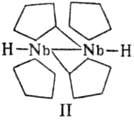
М. элементов начала больших периодов электроне дефицитны и в ряде реакций ведут себя аналогично карбенам: очень неустойчивы к окислению и нагреванию. Так, ниобоцен, полученный только в растворе, при комнатной температуре быстро превращ. в биядерный комплекс (II).
М. получают реакцией солей или ацетилацетонатов переходных металлов с циклопентадиенидами щелочных металлов, Mg, T1; действием циклопентадиена на соль (в присут. основания) или карбонил металла. При взаимодействии галогенидов некоторых металлов с C5H5Na+ образуются не М., а их производные — галогениды или гидриды, например (C5H5)2TiCl2, (C5H5)2ReH, (C5H5)2MoH2. В таких производных кольца расположены непараллельно.
М. — катализаторы и сокатализаторы в гомог. каталитич. реакциях, лек. препараты, присадки к топливам и маслам, промежут. продукты в орг. синтезе.
Первый М. (ферроцен) синтезировал в 1951 П. Посон с сотрудниками, его "сэндвичевая" структура установлена в 1952 Р. Вудвордом и Дж. Уилкинсоном.
Лит.: Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, ч. 3, пер. с англ., М., 1969; Перевалова Э. Г., Никитина Т. В., в сб.: Методы элементоорганической химии. Типы металлоорганических соединений переходных металлов, кн. 2, под общ. ред. А. Н. Несмеянова и К. А. Кочеткова, М., 1975, с. 687–726.
Э. Г. Перевалова
Значения в других словарях
- металлоцены — орф. металлоцены, -ов, ед. -цен, -а (хим.) Орфографический словарь Лопатина
