коферменты
КОФЕРМЕНТЫ (коэнзимы) (от лат. со- — приставка, означающая совместность, и ферменты)
орг. прир. соед., необходимые для осуществления каталитич. действия ферментов. Эти вещества, в отличие от белкового компонента фермента (апофермента), имеют сравнительно небольшую мол. массу и, как правило, термостабильны. Иногда под К. подразумевают любые низкомол. вещества, участие которых необходимо для проявления каталитич. действия фермента, в т. ч. и ионы, напр. К+, Mg2+ и Mn2+. Располагаются К. в активном центре фермента и вместе с субстратом и функциональными группами активного центра образуют активир. комплекс. К. должны обладать по крайней мере двумя функциональными участками или группировками, ответственными за специфич. связывание с апоферментом и субстратом. Часто К. прочно связаны с апоферментом — образуют с ним трудно диссоциирующие или недиссоциирующие комплексы либо соединены с полипептидной цепью ковалентной связью (такие К. наз. простетич. группой). В этом случае К. обычно остаются в составе фермента на всех стадиях каталитич. реакции. Примеры таких К. — флавиновые коферменты (см. рибофлавин) и пиридоксаль-5'-фосфат (см. витамин B6). Легко диссоциирующие К. — обычно К. — переносчики, действие которых связано с переходом от одной молекулы фермента к другой. Некоторые К., напр. НАД (никотинамидадениндинуклеотид; см. ниацин), в зависимости от каталитич. реакций, в которых они участвуют, могут функционировать как простетич. группа или покидать активный центр фермента. Известны десятки орг. соед., выполняющих функции К. Эти вещества, как правило, содержат системы сопряженных π-связей и (или) гетероатомы. Многие К. включают в качестве структурного компонента остаток молекулы витамина (т. наз. коферментные формы витаминов). Различают две группы К. Относящиеся к первой группе К. участвуют в реакциях, в которых превращ. субстрата катализируется одним ферментом. При этом К. может регенерироваться после каждого каталитич. акта в составе фермента, катализирующего превращ. субстрата, или как косубстрат. В последнем случае регенерация К. осуществляется др. ферментом в сопряженной реакции (в таких реакциях противопоставление К. и субстрата носит условный характер). К. второй группы участвуют в активации и переносе молекул субстрата (или их частей) от одного фермента к другому. В этом случае первоначально субстрат реагирует с К. в активном центре фермента с образованием достаточно устойчивого соед., которое может в неизменном виде переноситься в клетке к др. ферменту, в активном центре которого осуществляются каталитич. превращ. субстрата и одноврем. регенерация К. Образование комплекса апофермента с К. — один из способов регуляции активности фермента в организме (см. регуляторы ферментов). Ниже рассмотрены важнейшие К. Никотинамидные К. — коферментная форма витамина ниацина. К этой группе К., универсальных по распространению (они найдены буквально во всех живых клетках) и биол. роли, относятся НАД (формула I; R=Н) и никотинамидадениндинуклеотидфосфат, или НАДФ [I; R=РО(OH)2], а также восстановленные (по пиридиновому кольцу) формы этих соед. (соотв. НАДН и НАДФН). наиб. важная биохим. функция этих К. — их участие в переносе электронов и водорода от окисляющихся субстратов
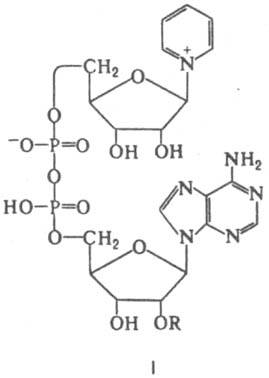
к кислороду в клеточном дыхании. При участии НАД или НАДФ, связанных прочно или легко диссоциирующих, ферменты дегидрогеназы (напр., алкогольдегидрогеназа, глутаматдегидрогеназа) катализируют обратимое превращ. спиртов, гидроксикислот и некоторых аминокислот в соответствующие альдегиды, кетоны или кетокислоты. Флавиновые К. — коферментная форма витамина рибофлавина. Среди оксидоредуктаз дыхательной цепи, участвующих в переносе электронов и водорода, большое значение имеют флавопротеиды-ферменты, содержащие в качестве простетич. групп флавинмононуклеотид (ФМН; IIа) и флавинадениндинуклеотид (ФАД; IIб). В некоторых ферментах (напр., в сукцинатдегидрогеназе) ковалентная связь ФАД с апоферментом образована пирофосфатной группой К. и атомом N имадазольного кольца гистидина. Восстановление флавиновых К. осуществляется через ряд промежут. стадий, включающих образование радикалов.
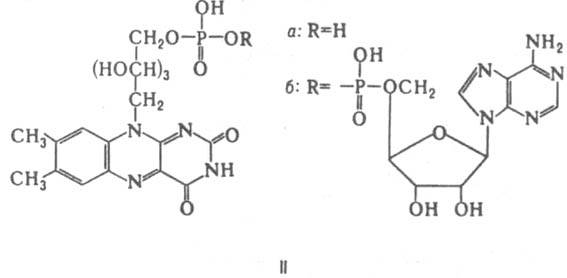
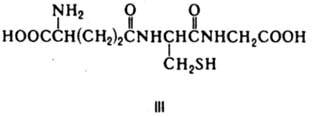
Главная функция флавиновых К. — перенос электронов (водорода) в окислительно-восстановит. цепи от НАДН и янтарной кислоты к цитохромам. Флавопротеиды катализируют также многочисл. реакции, механизм которых включает стадию одноэлектронного переноса; окисление восстановл. формы амида липоевой кислоты, синтез кобамидного кофермента из АТФ и витамина В12, окисление глюкозы и др. Глутатион (III)-К. некоторых ферментов, катализирующих превращение α-диальдегидов в α-гидроксикислоты, изомеризацию производных малеиновой кислоты в производные фумаровой кислоты (малеинат — цис-транс-изомераза) и енолизацию ароматич. α-кетокислот (фенилпируваттаутомераза).
К., содержащие порфириновый макроцикл. Эти К. в составе некоторых ферментов (напр., цитохромы а, б и с, цитохром-с-оксидазы) участвуют в клеточном дыхании. Аденозинтрифосфорная кислота (см. аденозинфосфорные кислоты) - К. ферментов, катализирующих перенос гл. обр. фосфатных и пирофосфатных групп (напр., фосфотрансфераз) на разл. субстраты у всех живых организмов. Известны также случаи переноса 5'-дезоксиаденозильного остатка от АТФ с отщеплением трифосфата. Кофермент А (КоASH, КоА; IV) — коферментная форма витамина пантотеновой кислоты. Ферменты, содержащие этот К., катализируют реакции, играющие важную роль в цикле трикарбоновых кислот. Этот цикл начинается с биосинтеза ацетилкофермента A [KoASC(O)CH3] в результате переноса ацетильной группы на KoASH с пировиноградной кислоты (фермент — пируватдегидрогеназа), а затем образования лимонной кислоты путем переноса ацетильной группы с
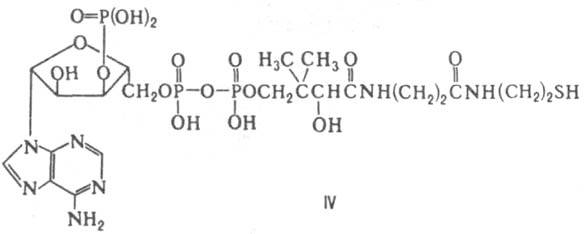
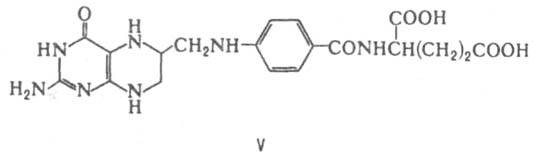
KoASC(O)CH3 на ацетилщавелевую кислоту (фермент-цитрат-синтаза). Кофермент А — также К. ферментов, участвующих в глиоксилатном цикле, окислении и синтезе жирных кислот, биосинтезе стероидов, каротиноидов, изопреноидов, нейтральных липидов и др. Во всех случаях KoASH действует как промежут. акцептор и переносчик разл. кислотных остатков, которые подвергаются в составе ацил — КоА тем или иным превращениям или передаются в неизменном виде на определенные метаболиты. Во всех случаях KoASH связан с ацильными остатками тиоэфирной связью. Тетрагидрофолиевая кислота (FH4; V) — коферментная форма витамина фолацина. Является К. ферментов, катализирующих перенос одноуглеродных групп [CH3, CH2, СН, СНО, СН(=NH)] в биосинтезе пуринов, пиримидинов и некоторых аминокислот. FH4 — K. ключевых ферментов в биосинтезе гетероцикла тимидина (напр., тимидилатсинтетазы) — структурного фрагмента молекул ДНК.
Пиридоксаль-5'-фосфат (VI) коферментная форма витамина В6. Входит в состав мн. ферментов, катализирующих превращения α-аминокислот, в т. ч. их рацемизацию, переами-нирование, декарбоксилирование, элиминирование или замещение у β- и γ-атомов углерода. Осн. стадия в механизме этих реакций образование основания Шиффа в результате взаимод. α-аминогруппы
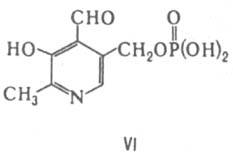
кислоты и карбонильной группы К. (см., напр., аспартатаминотрансфераза, изомеразы). Тиаминдифосфат (тиаминпирофосфат, кокарбоксилаза, ТДФ; VII) — коферментная форма витамина тиамина. К. мн. ферментов, катализирующих превращения α-кетокислот
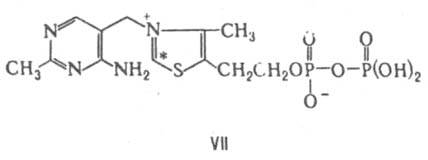
и кетоз, в т. ч. декарбоксилирование (фермент пируватдекарбоксилаза) и окислит. декарбоксилирование пировиноградной кислоты (в последнем случае с участием липоевой кислоты), при образовании и расщеплении α-гидроксикетонов и дикетонов под влиянием фосфо- и транскетолаз. Реакц. центр ТДФ — атом С в положении 2 тиазолиевого кольца (обозначен звездочкой), который легко образует карбанион в результате элиминирования H+. Механизм каталитич. реакции обычно включает образование ковалентной связи в результате взаимод. субстрата (или его фрагмента) с этим карбанионом. Биотин (VIII) — К. ферментов, катализирующих перенос группы CO2 в обратимых реакциях карбоксилирования. Молекула биотина связана с апоферментом пептидной связью, образованной его карбоксильной группой и ε-аминогруппой лизина в апоферменте (биотиниллизиновый остаток наз. биоцитином). Переносимая группа CO2 обратимо связывается с атомом в положении 1' биотина. Один из важных ферментов, в котором биотин выполняет функции К., — пируваткарбоксилаза.
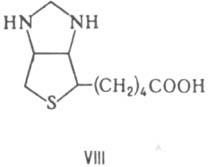
Она катализирует АТФ — зависимую реакцию образования щавелевоуксусной кислоты из пировиноградной и HCO−3. Кобамидные К. (кобаламиновые К., формулы см. в ст. Витамин В12). К этой группе относятся два К. — метилкобаламин и 5' — дезоксиаденозилкобаламин. Первый участвует в составе ферментов, катализирующих перенос групп CH3, напр. при синтезе метионина из гомоцистеина. Биол. роль второго К. состоит в участии в составе ферментов в каталитич. превращениях диолов в альдегиды (пропандиолдегидратаза), алканоламинов в альдегиды (этаноламин — аммиак-лиаза) и рибонуклеотидов в дезоксирибонуклеотиды (рибонуклеотидредуктаза), метилмалонил-кофермент А в сукцинил-кофермент А (метилмалонил-СоА-мутаза). Важная особенность этих К. — гомолиз связи Со—С в каталитич. реакциях. Некоторые К., напр. аденозинтрифосфорная кислота, 5'-дезок-сиаденозилкобаламин (кобамамид), тиаминдифосфат (кокарбоксилаза), флавинадениндинуклеотид (флавинат), применяют как лек. средства; многие К. — лиганды в аффинной хроматографии.
Лит.: Коферменты, под ред. В. А. Яковлева, М., 1973; Диксон М., Уэбб Э., Ферменты, пер. с англ., т. 1–3, М., 1982; Дюга Г., Пенни К., Биоорганическая химия, пер. с англ., М., 1983, с. 398 486; Ленинджер А.. Основы биохимии, пер. с англ., т. 1. М., 1985, с. 275–301; Общая органическая химия, пер. с англ., т. 10, М., 1986, с. 580–648.
А. М. Юркевич
Значения в других словарях
- коферменты — Органические соединения небелковой природы, входящие в состав активного центра некоторых ферментов. Соединяясь с апоферментом, К. образует каталитически активный комплекс. Многие... Микробиология. Словарь терминов
- Коферменты — [от лат. co (cum) — вместе и Ферменты], органические соединения небелковой природы, участвующие в ферментативной реакции в качестве акцепторов отдельных атомов или атомных групп, отщепляемых ферментом от молекулы субстрата. Большая советская энциклопедия
- коферменты — КОФЕРМЕНТЫ, коэнзимы, низкомолекулярные органич. соединения, входящие в состав ферментов и необходимые для проявления их активности. • см. также ферменты Ветеринарный энциклопедический словарь
- коферменты — (от лат. со – вместе и — ферменты), коэнзимы, органические соединения небелковой природы, входящие в состав активного центра нек-рых ферментов. Соединяясь с апоферментом, К. образуют каталитически активный комплекс — т. н. холофермент. Мн. Биологический энциклопедический словарь
- коферменты — Органические соединения, входящие в качестве небелкового компонента в состав сложных ферментов; необходимы для проявления каталитической активности ферментов. Коферментами служат многие витамины, поэтому их недостаток в организме животных и человека может приводить к нарушениям обмена веществ. Биология. Современная энциклопедия
- Коферменты — (синоним коэнзимы) органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Соединяясь с белковой частью молекулы фермента — апоферментом... Медицинская энциклопедия
- КОФЕРМЕНТЫ — КОФЕРМЕНТЫ — органические соединения небелковой природы, входящие в состав некоторых ферментов. Соединяясь с апоферментом, коферменты образуют каталитически активные комплексы. Многие коферменты — производные витаминов (В1, В2, В6 РР и др.). Большой энциклопедический словарь
