качественный анализ
КАЧЕСТВЕННЫЙ АНАЛИЗ
идентификация (обнаружение) компонентов анализируемых веществ и приблизительная количеств, оценка их содержания в веществах и материалах. В качестве компонентов м. б. атомы и ионы, изотопы элементов и отдельные нуклиды, молекулы, функц. группы и радикалы, фазы (см. элементный анализ, изотопный анализ, молекулярный анализ, органических веществ анализ, фазовый анализ). Первоначально К. а. возник как вид органолептич. восприятия продуктов потребления и производства для оценки их качества. В первую очередь это относилось к лек. веществам, для анализа которых был разработан т. наз. мокрый путь, т. е. анализ жидкостей и растворов. С переходом к производству и применению металлов возник пробирный анализ, первоначально как К. а. для определения подлинности благородных металлов. В дальнейшем он стал методом приближенного количеств, анализа. Одновременно развивались разл. варианты пирохим. К. а. для определения цветных металлов, железа, а также для анализа содержащих металлы минералов и руд. Качеств. аналит. сигналом при этом служили внеш. вид королька восстановленного металла, окраска конденсатов выделяющихся летучих продуктов, образование характерно окрашенных стекол ("перлов") при сплавлении анализируемых веществ с содой, бурой или селитрой. В основу анализа орг. соед. еще А. Лавуазье положил процессы сожжения с образованием CO2 и H2O. Далее этот метод был развит др. учеными на основе тех же пирохим. процессов и газового анализа, причем К. а. тесно слился с количественным. После открытия изомерии в К. а. было включено изучение хим. структуры орг. соединений. Классический орг. анализ — родоначальник микрохим. методов анализа и автоматич. анализаторов. Параллельно с хим. методами К. а. развивались и чисто физические — от метода установления хим. состава бинарного сплава путем измерения уд. веса (метод Архимеда) до спектроскопии, измерения эдс, поверхностного натяжения растворов и т. д. С сер. 20 в. значение физ. методов К. а. неизмеримо возросло. Качеств. и количеств, анализы развивались в тесном взаимод., т. к. только при уточнении количеств. данных возможна полная расшифровка качеств. компонентного состава вещества, а на основе данных К. а. — совершенствование количеств. анализа. При этом К. а. строится на основе возрастающей дифференциации свойств компонентов, а количественный — на возможности воспринимать и дифференцировать аналит. сигналы миним. интенсивности. Хим. методы элементного анализа неорг. соединений. Основаны на ионных реакциях и позволяют обнаруживать элементы в форме катионов и анионов. Для К. а. катионов используют разл. схемы систематич. анализа с последоват. разделением катионов на группы и подгруппы, внутри которых возможна идентификация отдельных элементов. Аналит. группы обычно именуют по групповому реагенту.
1. Группа соляной кислоты; в нее входят Ag, Hg(I), Pb, Tl(I), которые образуют хлориды, малорастворимые в воде и кислых растворах, а также W, Nb, Ta, образующие в этих же условиях малорастворимые гидраты оксидов.
2. Группа гидразина; в нее входят Pd, Pt, Au, Se, Те, которые восстанавливаются в кислом растворе; при отсутствии благородных металлов эта группа опускается, a Se и Те переходят в следующую.
3. Группа сероводорода. Подразделяют на три подгруппы: а) меди — Cu, Pb, Hg(II), Bi, Cd; образуют сульфиды, нерастворимые в полисульфиде аммония (NH4)2Sn; б) мышьяка — As, Sb, Sn; образуют тиосоли, растворимые в (NH4)2Sn; в) более редких элементов — Ge, Se, Те, Mo; образуют сульфиды, растворимые в (МH4)2Sn:
4. Группа (NH4)2S — уротропина, элементы которой образуют сульфиды или гидроксиды, малорастворимые в аммиачном растворе (NH4)2S. Подразделяют условно на три подгруппы: а) элементы со степенью окисления +2-Со, Ni, Mn, Zn; б) элементы со степенью окисления + 3 — Fe, A1, Cr; в) др. элементы — Be, Ga, In, Sc, Y, La, Th, U, Ti, Zr, Hf, Nb, Та (при наличии катионов этой подгруппы предварительно отделяют элементы с высокими степенями окисления обработкой уротропином в слабокислой среде). К этой группе относят также V, W, образующие первоначально растворимые тиосоли, разрушающиеся при подкислении.
5. Группа (NH4)2CO3; в нее входят Ca, Sr, Ba, которые образуют карбонаты, малорастворимые в аммиачной среде, и не образуют осадков с описанными групповыми реагентами.
6. Группа растворимых соед., не образующих осадков со всеми указанными групповыми реагентами, — Li, Na, К, Mg, Rb, Cs. В учебных курсах нумерацию групп часто обращают, начиная ее с группы растворимых соединений. Недостатки описанной схемы: плохое отделение Zn2+ от Cd2+, неточное разделение Sn2+, Pb2+, соосаждение некоторых сульфидов четвертой группы (Fe и Zn) с CuS, окисление сульфидов в растворимые сульфаты и др., а также высокая токсичность H2S. Имеются бессероводородные методы систематич. К. а. К ним относятся методы с применением заменителей H2S, дающих ион S2− в водных растворах (тиомочевина, тиоацетамид, тиосульфат), и наиб. распространенные методы без иона S2−: кислотно-щелочной, аммиачно-фосфатный, гидразин-гидроксиламиновый, фторидно-бензоатный и др. Напр., в кислотно-щелочном методе катионы разделяют на группы малорастворимых хлоридов или сульфатов, амфотерных гидроксидов, нерастворимых в щелочах гидроксидов, амминокомплексов, растворимых в воде солей. Полные схемы систематич. К. а. осуществляются редко. Обычно их используют частично в соответствии с конкретным набором ионов, для разделения ионов металлов в количеств. анализе, а также в учебных курсах аналит. химии. К. а. смесей неметаллов (исключая анализ орг. веществ) осуществляют путем идентификации анионов в водных и водно-орг. средах. Анионы не имеют общеустановленного разделения на группы, число которых значительно варьирует в разных схемах анализа. Обычно анионы классифицируют по признаку растворимости солей (табл. 1) и по признаку окислительно-восстановит. активности (табл. 2). Групповые

реагенты в анализе анионов служат только для их обнаружения (в отличие от катионов, где такие реактивы служат и для разделения). Для отделения катионов, мешающих обнаружению анионов, анализируемый раствор предварительно обрабатывают 1 М раствором соды для осаждения карбонатов, гидроксокарбонатов и гидроксидов тяжелых металлов (на карбонат-ион, возможно имеющийся в пробе, проводят предварит. испытание). При наличии в анализируемом веществе ионов, для которых существуют селективные реагенты, их обнаружение проводят из исходного раствора с помощью характерных индивидуальных  реакций (дробный метод). При этом обычно сначала изолируют мешающие компоненты осаждением или маскированием, а затем специфич. реакцией идентифицируют искомый ион. Основой для создания дробного анализа послужило получение большого набора реагентов органических на ионы неорг. веществ, а также разработка техники капельного анализа. Разработан дробный метод полного К. а. катионов и анионов. Техника проведения К. а. развивается в направлении отказа от макрометодов и перехода к полумикро- (100–10 мг), микро- (10–0,1 мг) и ультрамикрометодам (менее 0,1 мг). Полумикроанализ широко применяют в учебной работе; микро- и ультрамикроанализ — при исследовании биол. объектов, а также в электронной технике, особенно полупроводниковой, и радиохимии. Количеств. характеристика методик К. а. — предел обнаружения, т. е. миним. количество искомого компонента (в мкг или нг), которое м. б. надежно идентифицировано: для растворов используется величина предельной концентрации Сx, min или обратная ей величина предельного разбавления Dх (предельный объем раствора, который приходится на 1 мкг определяемого компонента). Предел обнаружения и Сх, min связаны друг с другом выражением:
реакций (дробный метод). При этом обычно сначала изолируют мешающие компоненты осаждением или маскированием, а затем специфич. реакцией идентифицируют искомый ион. Основой для создания дробного анализа послужило получение большого набора реагентов органических на ионы неорг. веществ, а также разработка техники капельного анализа. Разработан дробный метод полного К. а. катионов и анионов. Техника проведения К. а. развивается в направлении отказа от макрометодов и перехода к полумикро- (100–10 мг), микро- (10–0,1 мг) и ультрамикрометодам (менее 0,1 мг). Полумикроанализ широко применяют в учебной работе; микро- и ультрамикроанализ — при исследовании биол. объектов, а также в электронной технике, особенно полупроводниковой, и радиохимии. Количеств. характеристика методик К. а. — предел обнаружения, т. е. миним. количество искомого компонента (в мкг или нг), которое м. б. надежно идентифицировано: для растворов используется величина предельной концентрации Сx, min или обратная ей величина предельного разбавления Dх (предельный объем раствора, который приходится на 1 мкг определяемого компонента). Предел обнаружения и Сх, min связаны друг с другом выражением:
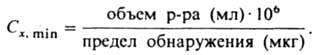
Иногда пользуются величиной pDx=-lgDx; для большинства микрохим. реакций К. a. pDx = 4–6. Хим. методы К. а. орг. соединений. В составе орг. сосд. обычно идентифицируют С, Н, О, N, S, Р, галогены и др. Углерод — по CO2, образующемуся после сжигания пробы в раскаленной трубке в присутствии CuO; водород — по H2O, конденсирующейся на холодных участках трубки, или по H2S, который образуется после прокаливания пробы с безводными Na2SO3 и Na,S2O3 и обнаруживается бумагой, пропитанной раствором (CH3COO)2Pb или нитропруссида натрия. Азот, серу и галогены определяют после разложения вещества расплавленным К или Na в открытых или запаянных стеклянных трубках по качеств, реакциям в растворе на образующиеся KCN (или NaCN), сульфиды, тиоцианаты, цианаты и галогениды; одновременно определяют наличие углерода по остатку на фильтре. Кислород обычно идентифицируют по функц. группам (карбонильной, альдегидной и др.); для прямого обнаружения пробу нагревают в токе N2 или H2 в присутствии платинового катализатора и идентифицируют по CO2 и H2O. Фосфор обнаруживают по реакции с (МH4)2MoO4, а мышьяк-по реакции с H2S после оглавления исследуемого вещества с содой или селитрой и обработки остатка HCl. Металлы идентифицируют в зольном остатке после сожжения пробы. Ряд специфич. и чувствительных реакций для элементного анализа орг. соед. предложен в системе капельного анализа с помощью цветных реакций. Приборами для одновременного качеств, и количеств, элементного анализа служат автоматич. анализаторы типов CHN, CHNS, ClBrICHNS, которые снабжены специфич. сорбционными или серийными хроматографич. устройствами для разделения продуктов разложения и детекторами для их идентификации. Важный метод исследования орг. соед. — функциональный К. а., т. е. обнаружение атомов или групп атомов, определяющих строение данного класса орг. соед. и их конкретные свойства. Хим. методы К. а. имеют практич. значение при необходимости обнаружения только неск. элементов. Для многоэлементного К. а. применяют физ.-хим. методы, такие как хроматография, электрохим. методы, в осн. полярография, и др. и физические методы, напр., атомно-эмиссионную спектрометрию (см. спектральный анализ) (предел обнаружения 1 мкг на 1 г твердой пробы или 1 мл раствора), атомно-абсорбционный анализ (предел обнаружения порядка пикограммов), рентгеноэмиссионный и рентгенофлуоресцентный анализ (см. рентгеновская спектроскопия) (миним. анализируемый объем 1 мкм3, предел обнаружения 10−2–10−3% по массе). Молекулярный и функциональный К. а. проводят с помощью инфракрасной спектроскопии, комбинационного рассеяния спектроскопии, ядерного магнитного резонанса, электронного парамагнитного резонанса. Особое место в совр. К. а. занимает масс-спектрометрия и хромато-масс-спектрометрия (ниж. предел обнаружения — 10−7% по массе). В основе фазового К. а. лежат процессы выделения отдельных фаз из сплава или руды и установление их состава хим. или физ.-хим. методами. Наиб. значение имеет рентгеновский фазовый анализ и термогравиметрия (особенно при анализе минералов). К. а. и полуколич. анализ фаз в гетерофазной системе возможно также осуществить на шлифе образца посредством электронного микрозонда. Для анализа нуклидов используют активационный анализ. В совр. неорг. К. а. ведущая роль принадлежит физ. методам, которые позволяют решать задачи идентификации и установления строения хим. соед., определения их локализации в объекте, установления типа хим. связи между атомами и группами атомов; в орг. К. а. хим. и физ. методы используются комплексно.
Лит.: Губен-Вейль, Методы органической химии, т. 2 — Методы анализа, 2 изд., М., 1967; Мурашова В. И., Тананаева А.Н., Ховякова Р.Ф., Качественный химический дробный анализ, М., 1976; Ляликов Ю.С., Клячко Ю.А., Теоретические основы современного качественного анализа, М., 1978; Гельман Н. Э.. Кипаренко Л. М., Автоматический элементный анализ органических соединений, "Ж. Всес. хим. общества им. Д.И. Менделеева", 1980, т. 25, №6, с. 641–51; Идентификация органических соединений, пер. с англ., М., 1983, с. 100-15: Иоффе Б. В., Костиков Р. Р., Разин В. В., Физические методы определения строения органических соединений, М., 1984; М азор Л.. Методы органического анализа, пер. с англ., М., 1986.
Ю. А. Клячко
Значения в других словарях
- Качественный анализ — Совокупность химических, физико-химических и физических методов обнаружения и идентификации элементов, радикалов, ионов и соединений, входящих в состав анализируемого вещества или смеси веществ. К. а. — один из основных разделов аналитической химии. Большая советская энциклопедия
- качественный анализ — Способ описания лингвистической системы, основывающейся на противопоставлении "наличие-отсутствие" данного явления без обращения к характеристике его частотности. Толковый переводоведческий словарь / Л.Л. Нелюбин. — 3-е изд., перераб. — М.: Флинта: Наука, 2003 Толковый переводоведческий словарь
- Качественный анализ — В экспертных исследованиях обнаружение химических веществ или их компонентов. К.а. отличают специфичность, т. е. возможность обнаружения искомого компонента в присутствии примесей... Криминалистическая энциклопедия
- КАЧЕСТВЕННЫЙ АНАЛИЗ — КАЧЕСТВЕННЫЙ АНАЛИЗ, идентификация химических элементов или ионов в веществе или смеси веществ. см. также КОЛИЧЕСТВЕННЫЙ АНАЛИЗ. Научно-технический словарь
- Качественный анализ — (a. qualitative analysis; н. qualitative Analyse; ф. analyse qualitative; и. analisis cualitativo) — обнаружение (идентификация) компонентов (хим. элементов, молекул соединений, ионов одного хим. состава, но разной зарядности, минералов и др. Горная энциклопедия
- КАЧЕСТВЕННЫЙ АНАЛИЗ — КАЧЕСТВЕННЫЙ АНАЛИЗ — обнаружение (идентификация) химических веществ или их компонентов; раздел аналитической химии. Важнейшие характеристики методов качественного анализа: 1) специфичность, т. Большой энциклопедический словарь
- Качественный анализ — См. Анализ (химич.). Энциклопедический словарь Брокгауза и Ефрона
