индуктивный эффект
ИНДУКТИВНЫЙ ЭФФЕКТ (индукционный эффект)
(позднелат. inductivus, от лат. inductio — наведение, побуждение), вид взаимного влияния атомов в молекулах, заключается в электростатич. воздействии зарядов на атомах или электрич. диполей связей на реакц. центр или к.-л. рассматриваемый атом (индикаторный атом). Наиб. сильное и медленно затухающее влияние (напряженность электрич. поля обратно пропорциональна квадрату расстояния) оказывают заряженные заместители, напр. NR3+, SO3−, O−. Индуктивное влияние заместителей на константы равновесия или скорости реакций выражается изменением разностей своб. энергий dDG продуктов (или переходного состояния) и исходных веществ для замещенного соед. по сравнению со стандартным. Например, при диссоциации кислот RCOOH появляется отрицат. заряд е между атомами кислорода карбоксилатной группы. Он взаимод. с заместителем, несущим электрич. заряд, на расстоянии r с энергией dDG = e2r−1. При наличии в молекуле полярного заместителя X (см. рис.)
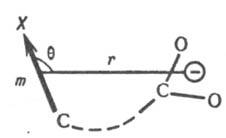
dDG зависит от величины электрич. дипольного момента m, связи С—X, расстояния r между точкой локализации диполя связи (обычно в центре тяжести суммарного заряда валентных электронов) и реакц. центром и угла q между направлениями m и r: dDG = — em cos qr−2. И. э. проявляется также в сдвиге электронов хим. связей под действием внутримол. электрич. поля. Количественно он выражается величиной индуцир. дипольного момента mi, которая пропорциональна поляризуемости связи b в напряженности поля E: mi = bЕ. И. э. ведет к изменению полярности хим. связей. В ряду CH3Cl, CH2Cl2, CHCl3 дипольные моменты соед. равны соотв. (в Кл∙м): 6,23∙10−30; 4,63∙10−30; 3,50∙10−36. Увеличение размера легко поляризуемого углеводородного радикала обусловливает возрастание дипольного момента молекулы (в скобках приведены значения m∙1030 в Кл∙м): CH3Cl (6,23), C2H5Cl (6,30), изо-C3H7Cl (6,68), трет-C4H9Cl (7,71), 1-адамантилхлорид. В результате И. э. электронная плотность на реакц. центре или индикаторном атоме может увеличиваться (положит. И. э., +I) или уменьшаться (отрицат. И. э., —I). И. э. заряженного заместителя определяется знаком заряда: положительно заряженный является акцептором электронов, т. е. проявляет —I-эффект; отрицательно заряженный — донор (+I-эффект). Электроотрицат. группы обычно проявляют —I-эффект, а алкильные радикалы, кремний-, германий- и оловосодержащие группы и т. п. +I-эффект. Однако при малых углах q возможен "обратный" И. э. Важную роль играют взаимод. зарядов с индуцируемыми ими в углеводородных радикалах диполями. Они стабилизируют заряды любого знака и проявляются гл. обр. в газофазных реакциях протонирования и кислотной диссоциации. Возникновение дипольного момента молекулы под воздействием электрич. поля реагента наз. индуктомерным эффектом. В рамках формального подхода И. э. количественно описывается индуктивными константами заместителей σI или σ*. Константы σI вычисляют из значений рKa бицикло[2.2.2]октан-1-карболовых кислот, замещенных в положении 4, или мета-замещенных бензойных кислот, в которых исключено сопряжение: σI(Х) = ΔpKa/ρ, где ΔpKa — изменение pKа кислоты при введении заместителя X, реакц. постоянная ρ выбирается так, чтобы привести σI в шкалу констант Гаммета (см. корреляционные соотношения). Индуктивные константы Тафта σ* вычисляют из констант скорости гидролиза сложных эфиров XCOOR:
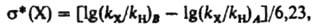
где индекс X относится к замещенному соед., Н — к стандарту, В — к щелочному, А — к кислотному гидролизу. Константы σI и σ* связаны уравнением σI = 0,16σ*. Индуктивные константы положительны для электроноакцепторных заместителей, отрицательны для электронодонорных по сравнению со стандартом (X = Н для σI, X = CH3 для σ*). Константы σI (даны в скобках) некоторых типичных заместителей имеют след. усредненные значения: СОО− (-0,22), Si(CH3)3 (- 0,13), CH3 (- 0,03), NH2 (0,09), Ph (0,13), OH (0,26), Cl (0,46), Br (0,46), СНО (0,30), COOH (0,30), CN (0,55), NO2 (0,65), 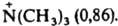 И. э. неск. заместителей, за исключением геминальных, аддитивен. При введении дополнит. метиленовой группы между заместителем и реакц. центром И. э. ослабляется приблизительно в 2,5 раза. На этом основаны представления о передаче И. э. по цепи атомов с равномерным ослаблением на каждом из них, что обозначается обычно стрелками на связях, указывающими направление сдвига электронов: X ! CH2 ! CH2 ! CH3. И. э. — наиб. универсальный вид внутримол. электронных взаимодействий. Учет его является необходимым при анализе мезомерных, стерических и др. эффектов.
И. э. неск. заместителей, за исключением геминальных, аддитивен. При введении дополнит. метиленовой группы между заместителем и реакц. центром И. э. ослабляется приблизительно в 2,5 раза. На этом основаны представления о передаче И. э. по цепи атомов с равномерным ослаблением на каждом из них, что обозначается обычно стрелками на связях, указывающими направление сдвига электронов: X ! CH2 ! CH2 ! CH3. И. э. — наиб. универсальный вид внутримол. электронных взаимодействий. Учет его является необходимым при анализе мезомерных, стерических и др. эффектов.
Лит.: Верещагин А. Н., Индуктивный эффект, М., 1987.
А. Н. Верещагин
