дисперсионное взаимодействие
ДИСПЕРСИОННОЕ ВЗАИМОДЕЙСТВИЕ
составляющая межмолекулярного взаимодействия, определяемая квантовомех. флуктуациями электронной плотности частиц (молекул, атомов). Мгновенное распределение электрич. заряда молекулы, которому отвечает мгновенный дипольный момент молекулы (или более высокого порядка мультипольный момент), индуцирует электрич. мультипольные моменты в др. молекуле. Энергия взаимод. этих мгновенных мультипольных моментов и есть энергия Д. в. Едисп. Д. в. между молекулами (атомами), находящимися в основных квантовых состояниях, всегда приводит к их притяжению. Энергию Едисп обычно представляют в виде разложения в ряд по обратным степеням расстояния R между молекулами:
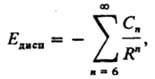
где Cn — коэф. разложения, n — целое число (n / 6). При больших R осн. вклад в значение Едисп дает диполь-дипольный член разложения —C6/R6. Значение C6 определяется через динамические поляризуемости αА и αB взаимодействующих молекул А и В. Точное выражение для C6 представляет собой интеграл от произведения поляризуемостей, зависящих от мнимого аргумента iw:
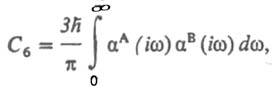
где h — постоянная Планка. Поскольку дисперсия света в веществе также определяется в конечном счете поляризуемостью молекул вещества, рассматриваемый вид межмолекулярного взаимод. получил назв. дисперсионного. Для качеств. оценок Едисп м. б. использованы приближенные формулы. Наиболее распространенные из них — формула Лондона:
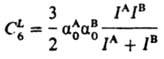
и формула Слейтера — Кирквуда (Слэтера-Кирквуда):
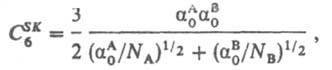
где α0A, α0B — статич. поляризуемости, IА, IB — первые потенциалы ионизации, NA, NB — число валентных электронов во взаимодействующих молекулах соответственно. Формула Лондона дает, как правило, для C6 оценки снизу, формула Слейтера — Кирквуда — сверху. Д. в. имеет место между всеми молекулами, независимо от наличия у них мультипольных моментов. Для неполярных молекул, а также для молекул с небольшими дипольными моментами (СО, HI, HBr и др.) силы притяжения определяются в основном Д. в. Именно oно ответственно за притяжение между атомами инертных газов на больших расстояниях. Д. в. обусловлено корреляцией между флуктуациями дипольных моментов взаимодействующих систем; при этом среднее значение флуктуирующего дипольного момента м. б. равно нулю. Зависимость Едисп от R−6 справедлива при условии, что электрич. заряды взаимодействуют мгновенно. При расстояниях между молекулами а 100 нм необходимо учитывать запаздывание, связанное с тем, что скорость света с имеет конечное значение. Электромагнитное поле мгновенного дипольного момента 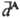 молекулы А "достигает" молекулу В за время R/c и индуцирует в ней дипольный момент
молекулы А "достигает" молекулу В за время R/c и индуцирует в ней дипольный момент 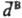 , который взаимодействует с
, который взаимодействует с 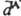 по прошествии времени 2R/c после его образования. За это время
по прошествии времени 2R/c после его образования. За это время 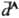 может измениться. В результате величина запаздывающего взаимод. меньше величины мгновенного, что отражается в более крутом спаде кривой зависимости энергии запаздывающего Д. в. от расстояния R. Для запаздывающего Д. в. справедлива асимптотич. формула Казимира — Полдера:
может измениться. В результате величина запаздывающего взаимод. меньше величины мгновенного, что отражается в более крутом спаде кривой зависимости энергии запаздывающего Д. в. от расстояния R. Для запаздывающего Д. в. справедлива асимптотич. формула Казимира — Полдера:
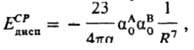
где α =1/137 — постоянная тонкой структуры (см. спин-орбитальное взаимодействие). Учет запаздывания важен, напр., в теории коагуляции коллоидных систем. Д. в. ответственно за силы взаимод., возникающие при сближении и макроскопич. тел (Е. М. Лифшиц, 1955). В этом случае к появлению Д. в. приводят флуктуации электромагнитного поля макроскопич. тела. Зависимость энергии Д. в. от расстояния R между телами будет иной, чем в случае взаимод. изолированных частиц, и определяется формой тел. Так, для двух плоских пластин энергия запаздывающего Д. в. зависит от R−3, для двух параллельных цилиндров — от R−6, для шариков — от R−7. Эти зависимости получили эксперим. подтверждение.
Лит.: Каплан И. Г., Введение в теорию межмолекулярных взаимодействий, М., 1982; Бараш Ю. С, Гинзбург В. Л., "Успехи физич. наук", 1984, т. 143, в. 2, с. 345; Молекулярные взаимодействия, пер. с англ., под ред. А. М. Бродского, М., 1984.
И. Г. Каплан
