диацетилен
ДИАЦЕТИЛЕН (1,3-бутандиин) HC≡C–C≡CH
мол. м. 50,06; т. пл. −36,4 °C, т. кип. 10,3 °C; d40 0,736; nD20 1,4386: 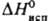 22,6 кДж/моль,
22,6 кДж/моль, 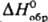 −472,8 кДж/моль; Cp0 73,69 Дж/(моль∙К);
−472,8 кДж/моль; Cp0 73,69 Дж/(моль∙К); 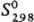 250,2 Дж/(моль∙К); раств. в органических растворителях, воде (в 1 объеме 4,6 объема Д.). По химическим свойствам Д. близок ацетилену, однако значительно более взрывоопасен. Устойчив ниже 0 °C, при комнатной температуре самопроизвольно полимеризуется. При взаимодействии с аммиачными растворами солей Cu(I) образует легко взрывающиеся ацетилениды CuC≡CC≡CH и CuC≡CC≡CCu. Метиновые атомы Н в молекуле Д. могут замещаться: а) оба одновременно, напр., при получении реактива Иоцича ClMgC≡CC≡CMgCl; б) только один, как в реакции Манниха:
250,2 Дж/(моль∙К); раств. в органических растворителях, воде (в 1 объеме 4,6 объема Д.). По химическим свойствам Д. близок ацетилену, однако значительно более взрывоопасен. Устойчив ниже 0 °C, при комнатной температуре самопроизвольно полимеризуется. При взаимодействии с аммиачными растворами солей Cu(I) образует легко взрывающиеся ацетилениды CuC≡CC≡CH и CuC≡CC≡CCu. Метиновые атомы Н в молекуле Д. могут замещаться: а) оба одновременно, напр., при получении реактива Иоцича ClMgC≡CC≡CMgCl; б) только один, как в реакции Манниха:
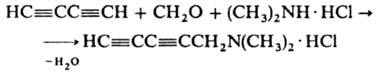
При взаимодействии с ацетоном Д. превращается в "дииндиол" (CH3)2C(OH)C≡CC≡CC(OH)(CH3)2 — реактив, используемый во мн. орг. синтезах (аналогично реактиву Гриньяра). Присоединение по тройным связям Д. происходит последовательно. При его гидрировании можно получить дивинил, при хлорировании — гексахлор-2-бутен, при взаимодействии со спиртами — HC≡CCH=CHOR и CH3C≡CCH(OR)2, при реакции с H2O — диацетил, при взаимодействии с алкиламинами или тиолами — соответствующие замещенные винилацетилена. Д. — побочный продукт при получении ацетилена электрокрекингом метана. Получают его димеризацией ацетилена (кат. — CuCl) дегидрохлорированием 1,4-дихлор-2-бутина или 1,2,3,4-тетрабромбутана, напр.:
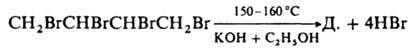
В высоких концентрациях Д. вызывает паралич дыхания.
Лит.: Физер Л., Физер М., Реагенты для органического синтеза, т. 1, М., 1970, с. 252. — 53.
Г. В. Дроздов
Значения в других словарях
- Диацетилен — (хим.) — C4H2 — первый член углеводородов ряда CnH2n — 6 — получен Байером при действии раствора цианистого калия на медное производное Д., получающееся, в свою очередь, из диацетиленкарбоновой кислоты (см. Фумаровая кисл.). Энциклопедический словарь Брокгауза и Ефрона
