диазоаминосоединения
ДИАЗОАМИНОСОЕДИНЕНИЯ (триазены)
моно-, ди- или тризамещенные производные не выделенного соединения — триазена 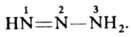 Все заместители м. б. орг. радикалами либо один из них — группой OH (N-гидрокситриазены), NO2 (N-нитротриазены), NO (N-нитрозотриазены), COOH (триазен-N-карбоновые кислоты), SO3H (триазен-N-сульфокислоты). Наиб. значение имеют ди- и тризамещенные Д., а из них — ароматич. и жирно-ароматические. Д. — бесцв. или желтые гл. обр. твердые вещества. Плавятся с разл.; при 100–150 °C взрываются. Хорошо раств. в органических растворителях; в воде раств. Д., содержащие группы COOH, SO3 или ОН. Лучший метод очистки некоторых Д. — перегонка с водяным паром и хроматография. Для Д., как и для прочих стабильных диазосоединений, термодинамически устойчива транс-конфигурация, которая переходит в цис-конфигурацию при УФ облучении. Д. — более сильные основания, чем азосоединения. При их протонировании образуется неустойчивый диазоаммониевый катион, диссоциирующий на катион диазония и амин:
Все заместители м. б. орг. радикалами либо один из них — группой OH (N-гидрокситриазены), NO2 (N-нитротриазены), NO (N-нитрозотриазены), COOH (триазен-N-карбоновые кислоты), SO3H (триазен-N-сульфокислоты). Наиб. значение имеют ди- и тризамещенные Д., а из них — ароматич. и жирно-ароматические. Д. — бесцв. или желтые гл. обр. твердые вещества. Плавятся с разл.; при 100–150 °C взрываются. Хорошо раств. в органических растворителях; в воде раств. Д., содержащие группы COOH, SO3 или ОН. Лучший метод очистки некоторых Д. — перегонка с водяным паром и хроматография. Для Д., как и для прочих стабильных диазосоединений, термодинамически устойчива транс-конфигурация, которая переходит в цис-конфигурацию при УФ облучении. Д. — более сильные основания, чем азосоединения. При их протонировании образуется неустойчивый диазоаммониевый катион, диссоциирующий на катион диазония и амин:
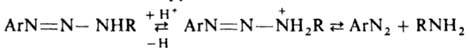
Кислотный гидролиз Д. широко используется для генерирования катионов диазония. Д., содержащие остаток ароматич. амина, у которого свободно пара- или орто-положение, в кислой среде в присутствии соответствующего амина при 40–50 °C перегруппировываются в аминоазосоединения по мсжмолекулярному механизму кислотного гидролиза (с образованием соли диазония и послед. ее азосочетанием с амином):
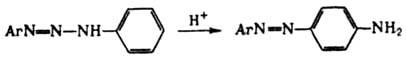
Д. проявляют также кислотные свойства, в частности способность к N-металлированию: ArN=N—NHR + MX → ArN=N—NMR + HX, где М = Ag, Cu, Hg или др., Х = NO3, Cl, OCOCH3 или др. Металлированные Д. присоединяют NH3, пиридин, тиомочевину и др. основания, а также растворители (напр., спирт, ацетон, воду), образуя прочные ярко окрашенные комплексы. На этом свойстве основано применение Д. как аналит. реагентов. В растворах дизамещенные Д. благодаря водородным связям образуют линейные и циклич. ассоциаты, способствующие 1,3-переносу протона (таутомерия). Из-за таутомерии продукты гидролиза могут не отвечать исходным компонентам (перенос диазогруппы), напр.:
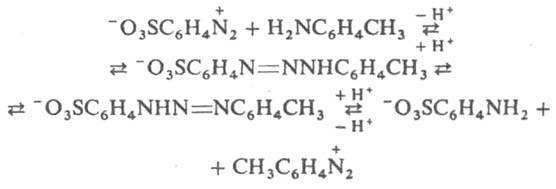
Восстанавливаются Д. обычно в производные гидразина и ариламина:
ArNH—N=N—Ar + 2H2 → ArNH2 + ArNHNH2
Термич. распад Д. происходит с выделением N2 и своб. радикалов 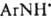 ,
, 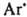 и
и 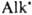 , диспропорционирование и рекомбинация которых со средой приводят к образованию ArNH2, ArH, Ar2 и др. углеводородов. Осн. способ получения Д. — взаимод. солей диазония с первичными или вторичными аминами при 0–20 °C чаще всего в воде (реже — в этаноле, уксусной или муравьиной кислоте, а также в полярных апротонных растворителях, напр. ДМФА). Образование Д. по аналогии с азосочетанием следует рассматривать как электроф. замещение у атома N аминогруппы с промежут. образованием диазоаммониевого катиона, концентрация которого мала и постоянна:
, диспропорционирование и рекомбинация которых со средой приводят к образованию ArNH2, ArH, Ar2 и др. углеводородов. Осн. способ получения Д. — взаимод. солей диазония с первичными или вторичными аминами при 0–20 °C чаще всего в воде (реже — в этаноле, уксусной или муравьиной кислоте, а также в полярных апротонных растворителях, напр. ДМФА). Образование Д. по аналогии с азосочетанием следует рассматривать как электроф. замещение у атома N аминогруппы с промежут. образованием диазоаммониевого катиона, концентрация которого мала и постоянна:
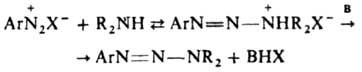
[В-растворитель, а также основания, напр., пиридин и его аналоги, анионы слабых кислот (фталевой, уксусной и пр.)]. Т. к. скорость образования Д. в значит. степени лимитируется отрывом протона от диазоаммониевого катиона, реакция катализируется основаниями. Для успешного образования Д. необходимо, чтобы не происходил его гидролиз. Поэтому чем основнее Д., тем ниже должна быть кислотность среды при его образовании (получение ароматич. Д. из компонентов с электронодонорными заместителями нельзя вести в кислой среде). При взаимодействии соли диазония с алифатич. амином среда должна быть слабощелочной. Если используется первичный алифатич. амин, происходит замена второго атома Н в амине с образованием бис-диазоаминосоединения (пентаза-1,4-диена) ArN=N—N(Alk)—N=NAr. Д. не образуются при реакции соли диазония с нафтиламинами. Многие Д. синтезируют взаимод. магнийорг. соединений с азидами:
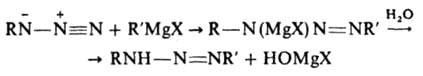
(X — галоген, R и R' — алифатич. или ароматич. радикалы). Осн. метод анализа и идентификации ароматич. и жирно-ароматич. Д. — кислотный гидролиз с послед, азосочетанием с нафтолами и колориметрич. определение азокрасителя. Для анализа Д. используется также цветная реакция образования кадмиевого производного. В промышленности Д. применяют для получения аминоазосоединений (азосоставляющая — анилин, N-алкиланилины и их производные), для крашения (компоненты диазаминолов; см. азогены). Д. открыты П. Гриссом в 1862.
Лит.: Цоллингер Г, Химия азокрасителей, пер. с нем., Л., 1960; Починок В. Я., Триазены, К., 1968.
А. В. Ельцов
Значения в других словарях
- Диазоаминосоединения — Триазены, органические соединения общей формулы где чаще всего R — ароматический радикал, R' — алифатический или ароматический радикал (один из R' может быть атомом водорода). Д. обычно получают взаимодействием диазония солей (См. Большая советская энциклопедия
- диазоаминосоединения — орф. диазоаминосоединения, -ний, ед. -ние, -я Орфографический словарь Лопатина
