диазепины
ДИАЗЕПИНЫ
мол. м. 94,10. Различают 1,2-, 1,3- и 1,4-Д. (формулы I-III соотв.).
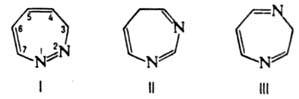
Для каждого Д. возможны 4 таутомера, напр., для 1,2-Д. 1Н-, 3Н-(формула I), 4Н- и 5Н-изомеры. Незамещенные Д. не известны; наиб. значение имеют гидрированные Д. и бензодиазепины. 1Н-1,2-Д. в кислом растворе протонированы по атому С-4 и изомеризуются в N-иминопиридиниевые илиды:
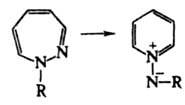
Под действием света образуют циклобутенодигидропиразолы формулы IV. В присут. муравьиной и трифторуксусной кислот 1Н-1,2-Д. димеризуются, в присутствии оснований (напр., RONa) превращаются в 2-аминопиридины. Под действием NaBH4 восстанавливаются в 1Н-2,3-дигидро-1,2-Д.; гидрирование над Pd приводит к 1Н-тетрагидро-1,2-Д.
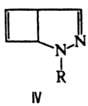
Получают 1Н-1,2-Д. фотоизомеризацией N-иминопиридиниевых илидов:
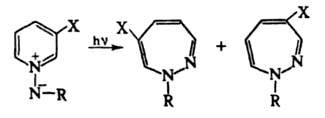
3H-1,2-Д. получают нагреванием β-замещенных N-тозилгидразонов ненасыщенных кетонов. 4H-1,2-Д. в кислой среде протонируются по атому N-1 и превращаются в смесь пиразолов и пиридинов. При нагр. 4H-1,2-Д. происходит сужение кольца с образованием пиридазинов. Получают взаимод. гидразина с пирилиевыми или тиопирилиевыми солями, а также фотолизом диазаноркарадиена, напр.:
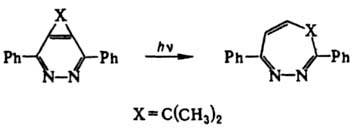
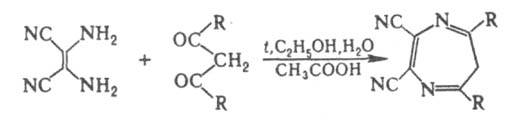
Все 1,2-Д. обладают свойствами диенов и присоединяют тетрацианэтилен по типу реакции Дильса — Альдера. 1,3-Д. изучены мало. Их получают взаимод. производных имидазола с диметиловым эфиром ацетилендикарбоновой кислоты; тетрагидропроизводные — из бензонитрила и 1,4-диаминобутана; гексагидропроизводные — из тетраметилендиизоцианата и воды. Дигидропроизводные 1,4-Д. устойчивы по отношению к дегидрированию, окислению, гидролизу. Катион дигидро-1 4-диазепиния легко вступает в реакции электроф. замещения. Гидрирование, галогенирование, нитрование и диазосочетание идут в положение 6. 6H-Производные получают конденсацией 1,2-диаминоалкенов с 1,3-дикарбонильными соед., напр.:
Лит.: Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 725.
Е. Н. Караулова
