галогенфосфины
ГАЛОГЕНФОСФИНЫ
соед. общей формулы RnPHal3_n, где и= 1,2; R-орг. радикал. Молекулы имеют пирамидальную форму; углы связей у Р составляют 98–102° (см. также табл. 1).
Табл. 1 — УСРЕДНЕННЫЕ ХАРАКТЕРИСТИКИ СВЯЗЕЙ ФОСФОРА С ГАЛОГЕНАМИ В ГАЛОГЕНФОСФИНАХ
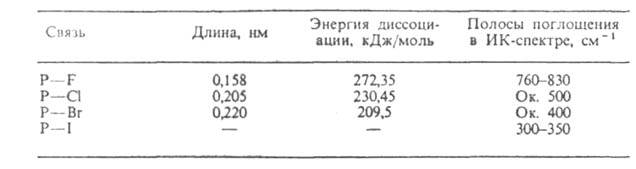
Табл. 2 — СВОЙСТВА ГАЛОГЕНФОСФИНОВ
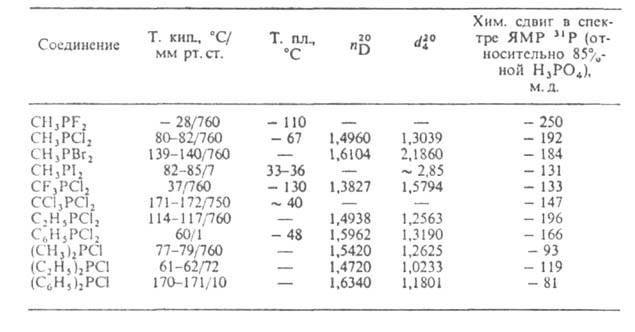
Свойства. Большинство Г. — жидкости (табл. 2) с характерным неприятным запахом; хорошо раств. в органических растворителях. Диапазон хим. сдвигов в спектре ЯМР 31Р относительно 85%-ной H3PO4 от 0 до 250 м. д.
Г. — слабые основания. Реагируют с веществами, имеющими в молекуле гидроксильную группу; в мягких условиях с водой образуют кислоты RPH(O)OH или R2P(O)H. Легко окисляются [напр., CH3PF2 и (CH3)2РС1 на воздухе воспламеняются]. Для окисления Г. в галогенангидриды фосфоновых или фосфиновых кислот используют O2, NO2, SO2C12. Сера и некоторые ее соед. окисляют Г. до веществ, содержащих связь P=S.
Многие Г. образуют сравнительно устойчивые комплексы с переходными металлами, напр.:
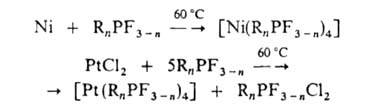
Связь металл-Р наиб. короткая и прочная в комплексах с фторфосфинами. Галогены, сульфенхлориды, сульфенамиды, хлорамины взаимод. с Г., образуя фосфораны:
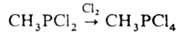 (иногда Hal внедряется в углеводородный радикал). При взаимодействии Г. с нуклеоф. реагентами могут образовываться соед. с различным координац. числом атома Р, напр.:
(иногда Hal внедряется в углеводородный радикал). При взаимодействии Г. с нуклеоф. реагентами могут образовываться соед. с различным координац. числом атома Р, напр.:
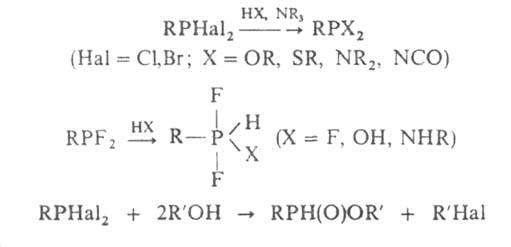
Г. взаимод. с альдегидами и кетонами с образованием α-галогеналкильных производных четырехкоординац. фосфора, с галогенангидридами карбоновых кислот — с образованием α-гидроксиалкильных, с иминами — α-аминоалкильных, напр.:
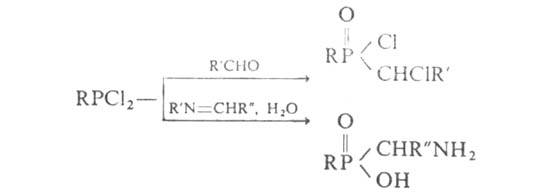
С ненасыщ. карбоновыми кислотами или диенами Г. дают фосфинаты и фосфиноксиды, в т. ч. циклич. структуры, напр.:
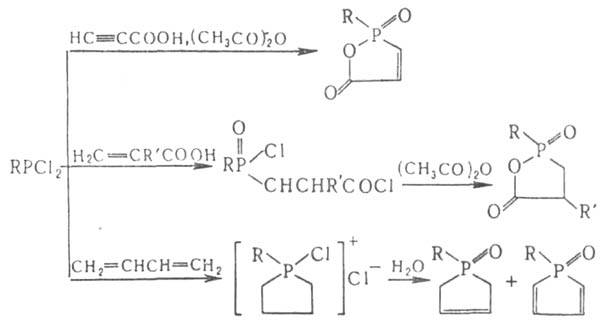
При восстановлении Г. образуются фосфины, циклопелифосфины или дифосфины, напр.:
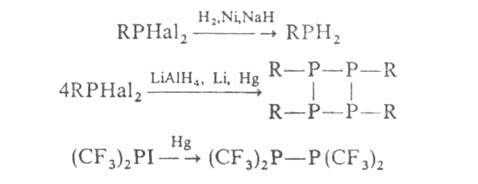
Соед. двух последних типов получаются также при разложении алкилфторфосфинов в процессе их хранения или при взаимодействии Г. с фосфинами.
Получение и применение. Наиб. разработаны методы синтеза алкил(арил)дихлорфосфинов и перфторалкилиодфосфинов. Метилдихлорфосфин получают с использованием алюминийорг. соед., напр.:
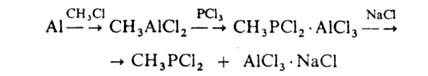
Возможно также использование др. металлоорганических соединений, напр.: PCl3 + (C2H5)4Pb → C2H5PCl2 (выход 96%).
Важное значение имеет высокотемпературный (~ 600 °C) синтез алкилдихлорфосфинов в газовой фазе при взаимодействии PCl3 с алканами. Процесс катализируется O2 и ингибируется непредельными углеводородами; выход в расчете на прореагировавший PCl3 достигает 80%. Алкилдихлорфосфины с удовлетворительными выходами можно получить также при пропускании углеводородов над PCl5, нагретым до 500–650 °C.
Ок. 200 °C в присутствии Р олефины реагируют с PCl3 с образованием бис-(дихлорфосфино)алканов с выходом 20–70%. Преимущественно дигалогенфосфины образуются: при пропускании паров хлористых или бромистых алкилов над красным Р при 260–400 °C (кат. — Cu, CuHal); при взаимодействии арил- или аралкилгалогенидов с Р (без катализатора); в реакциях белого Р с RHal в среде PCl3 (кат. — I2 или Br2). Нагреванием белого Р с CCl4 получают CCl3PCl2; при использовании CCl3Br вместо CCl4 образуются соед. со связями Р—Р. Полифторалкилиодфосфины (RF)nPI3_n получают взаимод. полифториодалканов с красным Р в присутствии I2 при 200–250 °C, алхилполифторалкилгалогенфосфины — алкилированием полифосфинов: (RP)n RR'PHal (R,R'-Alk, полифторалкил; Hal-I, Br).
RR'PHal (R,R'-Alk, полифторалкил; Hal-I, Br).
Г. с ароматич. радикалами получают по реакции Фриделя — Крафтса, напр.:
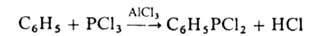
или взаимод. галогенидов трехвалентного Р с тетрафторборатами арилдиазония, напр.:
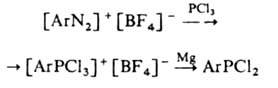
Г. можно синтезировать также восстановлением галогенидов четырех- или пятикоординац. Р или с использованием реакций замещения к.-л. группы на атом галогена, напр.:
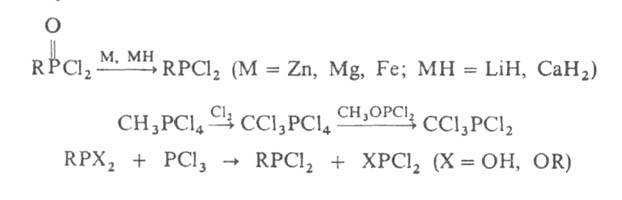
Для замены атомов одного галогена на атомы другого используют реакции:
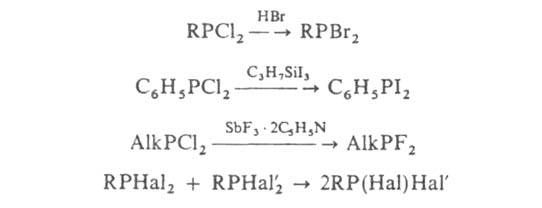
Г. — один из наиб. изученных классов фосфорорг. соединений. Их применяют в синтезе огнестойких пропиток текстильных материалов, инсектицидов, лек. препаратов, экстрагентов, катализаторов, антиоксидантов, модификаторов полимеров и др. См. также Диметилхлорфосфин, Метилдихлорфосфин.
Лит.: П у рдела Д., Вы л чану Р., Химия органических соединений фосфора, пер. с рум., М., 1972, с. 68–162; Houben-Weyl, Methoden der Organischen Chemie, 4 Aufl., Bd 12, Tl 2, Sttutg., 1964, S. 212–26; Emoto Т., "J. of Synthetic Organic Chemistry", 1970, v. 28, № 2, p. 143–76; "Angcwandte Chemie International Edition", 1981, Bd 20, S. 223.
Г. И. Дрозд
