вольфрама оксиды
ВОЛЬФРАМА ОКСИДЫ
В системе W-O (см. рис.) установлен состав четырех оксидов: триоксида WO3; промежут. оксидов W20O58, или WO2 90 (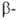 оксид), и W18O49, или WO2 72 (
оксид), и W18O49, или WO2 72 (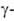 оксид); диоксида WO2 (
оксид); диоксида WO2 (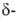 оксид). Структура В. о. построена из различно сочлененных октаэдрич. группировок WO6. Свойства В. о. приведены в табл.
оксид). Структура В. о. построена из различно сочлененных октаэдрич. группировок WO6. Свойства В. о. приведены в табл.
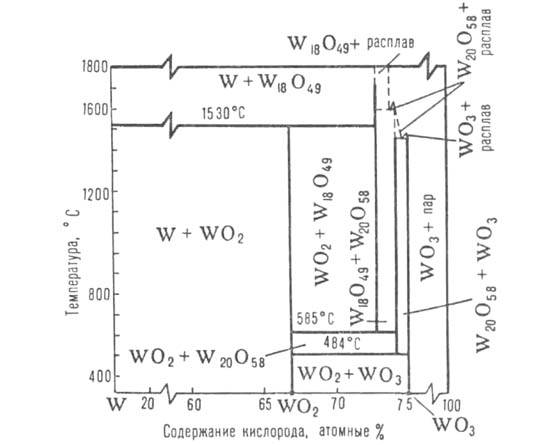
Фазовая диаграмма системы вольфрам — кислород. Пунктирными линиями обозначены приблизительные области сосуществования твердой и жидкой фаз для WO3, W20O58 и Wi8O49
СВОЙСТВА ОКСИДОВ ВОЛЬФРАМА
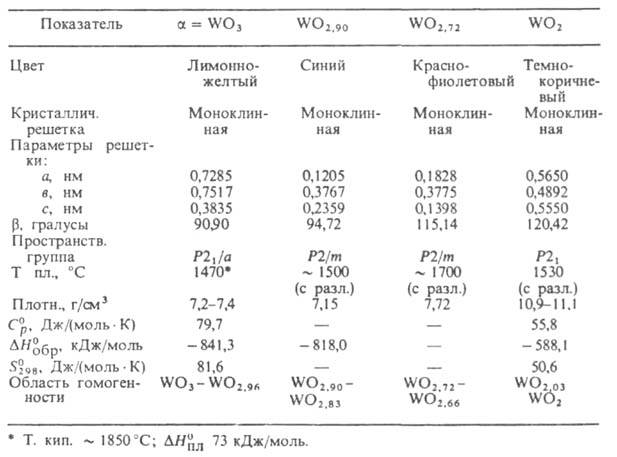
Триоксид WO3. До −27 °C устойчива моноклинная модификация, в интервале от −27 до 20 °C — триклинная, при 20–339 °C — моноклинная I WO3), при 339–740 °C — ромбическая, при 740–1470 °C — тетрагональная. Заметно возгоняется выше 800 °C. В газовой фазе существует в виде ди-, три- и тетрамеров. Практически не раств. в воде (0,02 г/л) и минер. кислотах (за исключением HF). Образует гидрат WO3*H2O-вольфрамовую кислоту (см. вольфраматы). С растворами щелочей, Na2CO3, а также NH3 (при нагр.) взаимод. с образованием вольфраматов. Восстанавливается до металла водородом при 700–900 °C, углеродом — выше 1000 °C. Получают термич. разложением вольфрамовой кислоты или (NH4)10[H2W12O42]*4H20 при 500–800 °C, а также окислением W на воздухе выше 500 °C. WO3 — промежут. продукт в производстве вольфрама. Его используют для получения карбидов и галогенидов W, вольфраматов, как пигмент для окрашивания керамич. и стеклянных изделий в желтый цвет, катализатор гидрогенизации и крекинга углеводородов.
WO3), при 339–740 °C — ромбическая, при 740–1470 °C — тетрагональная. Заметно возгоняется выше 800 °C. В газовой фазе существует в виде ди-, три- и тетрамеров. Практически не раств. в воде (0,02 г/л) и минер. кислотах (за исключением HF). Образует гидрат WO3*H2O-вольфрамовую кислоту (см. вольфраматы). С растворами щелочей, Na2CO3, а также NH3 (при нагр.) взаимод. с образованием вольфраматов. Восстанавливается до металла водородом при 700–900 °C, углеродом — выше 1000 °C. Получают термич. разложением вольфрамовой кислоты или (NH4)10[H2W12O42]*4H20 при 500–800 °C, а также окислением W на воздухе выше 500 °C. WO3 — промежут. продукт в производстве вольфрама. Его используют для получения карбидов и галогенидов W, вольфраматов, как пигмент для окрашивания керамич. и стеклянных изделий в желтый цвет, катализатор гидрогенизации и крекинга углеводородов.
 Оксид WO29 устойчив в интервале 485–1500 °C; ниже 485 °C диспропорционирует с образованием WO2 и WO3.
Оксид WO29 устойчив в интервале 485–1500 °C; ниже 485 °C диспропорционирует с образованием WO2 и WO3.
 Оксид WO2,72 устойчив в интервале 585–1700 °C; ниже 585 °C диспропорционирует с образованием WO2 и WO2 90.
Оксид WO2,72 устойчив в интервале 585–1700 °C; ниже 585 °C диспропорционирует с образованием WO2 и WO2 90.
β- и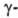 Оксиды мало раств. в воде, соляной кислоте и разб. H2SO4; окисляются HNO3. Обладают полупроводниковыми свойствами. Образуются при восстановлении WO3 водородом в присутствии паров воды при 300–600 °C. М. б. также получены при длит. нагревании в интервале 700–900 °C стехио-метрич. смесей WO3 с W или WO3 с WO2 в атмосфере Ar или N2.
Оксиды мало раств. в воде, соляной кислоте и разб. H2SO4; окисляются HNO3. Обладают полупроводниковыми свойствами. Образуются при восстановлении WO3 водородом в присутствии паров воды при 300–600 °C. М. б. также получены при длит. нагревании в интервале 700–900 °C стехио-метрич. смесей WO3 с W или WO3 с WO2 в атмосфере Ar или N2.
Диоксид WO2 (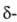 оксид) при температуре 1530 °C плавится с разложением на W и WO2,72. Диспропорционирует в твердой фазе при 900–1000 °C с образованием W и паров WO3. He раств. в воде, соляной кислоте и разб. H2SO4, окисляется HNO3. Получают восстановлением WO3 водородом при 575–600 SC
оксид) при температуре 1530 °C плавится с разложением на W и WO2,72. Диспропорционирует в твердой фазе при 900–1000 °C с образованием W и паров WO3. He раств. в воде, соляной кислоте и разб. H2SO4, окисляется HNO3. Получают восстановлением WO3 водородом при 575–600 SC
Лит. см. при ст. вольфрам.
А. Н. Зеликман
