бария оксид
БАРИЯ ОКСИД BaO
бесцветные кристаллы с кубич. решеткой (а = 0,5542 нм, пространственная группа Fm3m; плотн. 5,7 г/см3); при 23 °C и 9200 МПа превращ. в тетрагон, модификацию (а = 0,4459 нм, с = 0,3606 нм), при 14000 МПа — в тетрагональную др. типа (а = 0,4397 нм, с = 0,3196 нм, пространственная группа Р4/птп). Т. пл. 2017 °C; при нагр. возгоняется; C0p 46,99 Дж/(моль∙К), уравнение температурной зависимости: C0p = 48,117 + 11,527∙10−3Т — 3,896∙105 7−2 + 2,083∙10−6Т2 (298–2290 К); 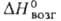 424,3 кДж/моль,
424,3 кДж/моль, 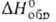 −548,0 кДж/моль,
−548,0 кДж/моль, 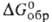 −520,5 кДж/моль; S0298 72,00 Дж/(моль∙К)), для газа 235,35 Дж/(моль∙К)); уравнение температурной зависимости давления пара над твердым BaO: 1gр(Па) = 10,99 — 19700/7(1200–1700 К). BaO — диамагнетик (
−520,5 кДж/моль; S0298 72,00 Дж/(моль∙К)), для газа 235,35 Дж/(моль∙К)); уравнение температурной зависимости давления пара над твердым BaO: 1gр(Па) = 10,99 — 19700/7(1200–1700 К). BaO — диамагнетик (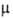 -0,13∙109). Теплопроводность 7,8–4,8 Вт/(м∙К) (80–1100 К). Растворимость (мол. %) при 1200 °C в расплавах солей: в NaCl-5,3, KCl — 3,4, Li2SO4 — 9,9, Na2SO4 — 7,6. Легко реагирует с водой, кислотами и CO2. Получают BaO термич. разложением BaCO3 при 700–900 °C или BaO2 при 500–600 °C.
-0,13∙109). Теплопроводность 7,8–4,8 Вт/(м∙К) (80–1100 К). Растворимость (мол. %) при 1200 °C в расплавах солей: в NaCl-5,3, KCl — 3,4, Li2SO4 — 9,9, Na2SO4 — 7,6. Легко реагирует с водой, кислотами и CO2. Получают BaO термич. разложением BaCO3 при 700–900 °C или BaO2 при 500–600 °C.
Прокаливанием BaO в парах Ba получают нестехио-метрич. оксиды Ва1+хО — голубые кристаллы. Уравнения зависимости х от давления пара Ва: х(в мольных долях) = 1,51∙10−5 р0.328 (в интервале давлений 4∙10−3 — 130 Па при 1473 К); х = 6,08∙10−5 р1,075 (в интервале 130–4270 Па при 1473 К). Нестехиометрич. оксиды — компоненты твердых растворов (вместе с SrO и CaO), являющихся материалами оксидных катодов электронно-лучевых трубок, видиконов, фотоэлектрич. преобразователей тока и др. электронно-вакуумных устройств.
При нагр. BaO ок. 500 °C в среде O2 получают пероксид BaO2 — бесцветные кристаллы с гексаген, решеткой (а = =0,534 нм, с = 0,677 нм, пространственная группа 14/ттл); плотн. 4,96 г/см3; C0p 66,94 Дж/(моль∙К), ΔH0обр −623,0 кДж/моль; 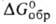 −575,27 кДж/моль; S0298 91,13 Дж/(моль∙К). Выше 500 °C разлагается с выделением O2; взаимод. с H2SO4, образуя H2O2. BaO2 — источник чистого O2, компонент пиротехн. составов, отбеливатель для тканей, бумаги.
−575,27 кДж/моль; S0298 91,13 Дж/(моль∙К). Выше 500 °C разлагается с выделением O2; взаимод. с H2SO4, образуя H2O2. BaO2 — источник чистого O2, компонент пиротехн. составов, отбеливатель для тканей, бумаги.
Лит.: Ковтуненко П. В., Xа риф Я. Я, "Успехи химии", 1979, т. 48, в. 3, с. 448–80.
П. В. Ковтуненко
