антрахинон
АНТРАХИНОН (от греч. anthrax — уголь и kina, на языке индейцев кечуа — кора хинного дерева)
мол. м. 208,20; светло-желтые кристаллы; т. пл. 287 °C, т. кип. 377 °C (с возг.); d420 1,438; C0p 265 Дж/(моль∙К); ΔH0пл 32,57 Дж/моль, ΔH0обр — 179 Дж/моль; хорошо раств. в большинстве орг. растворителей при нагр., напр. в этаноле -5% (18 °C), 22,5% (78 °C), толуоле1,9% (15 °C), 25,6% (100 °C), практически не раств. в воде (0,006% при 50 °C). Молекула А. — плоская, валентные углы близки 120°, длины связей (в нм) см. на рис.
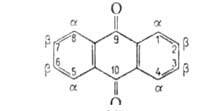
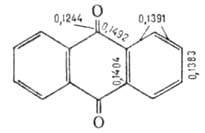
Кристаллич. решетка моноклинная (а = 1,5810 нм, b = 0,3942 нм, с = = 0,7865 нм,  =102,43°, пространственная группа P21/а). В УФ-спектре
=102,43°, пространственная группа P21/а). В УФ-спектре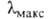 251, 279, 321 и 377 нм (
251, 279, 321 и 377 нм (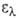 54∙103, 17,6∙103, 4,8∙103 и 110 соотв.); в ИК-спектре полоса поглощения при частоте А. обратимо переходит
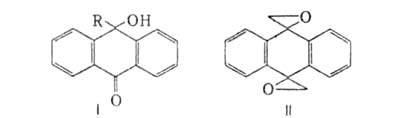
54∙103, 17,6∙103, 4,8∙103 и 110 соотв.); в ИК-спектре полоса поглощения при частоте А. обратимо переходит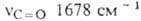 в 9,10-дигидроксиантрацен (антрагидрохинон) при восстановлении действием Na2S2O4 в щелочной среде, NaBH4 или H2 в присутствии катализатора. Более глубокое восстановление (напр., А1 в H2SO4) приводит к антрону и затем — к антрацену. При одноврем. действии восстановителя и ацилирующего или алкилирующего агента получают эфиры антрагидрохинона. А. присоединяет RMgHal или RLi к одной (формула I, R-Alk или Ar) либо к обеим карбонильным группам. При обработке ДМСО в присутствии NaH из А. образуется соед. формулы I, где R=CH2SO2CH3, а при послед. действии KOH в ДМСО-10-гидрокси-9-формилантрацен. При реакции с диметилсульфонийметилидом (CH3)2S=CH2 образуется производное с одним или двумя (формула II) оксирановыми циклами. Из соед. II при восстановлении получают 9,10-диметилантрацен, при действии ВF3-9,10-диформилантрацен. А. с трудом реагирует с гидроксиламином, давая монои диоксимы. Не взаимод. с гидразинами. При действии аналина и AlCl3 превращ. в 9,10-бис-(фениламин).
в 9,10-дигидроксиантрацен (антрагидрохинон) при восстановлении действием Na2S2O4 в щелочной среде, NaBH4 или H2 в присутствии катализатора. Более глубокое восстановление (напр., А1 в H2SO4) приводит к антрону и затем — к антрацену. При одноврем. действии восстановителя и ацилирующего или алкилирующего агента получают эфиры антрагидрохинона. А. присоединяет RMgHal или RLi к одной (формула I, R-Alk или Ar) либо к обеим карбонильным группам. При обработке ДМСО в присутствии NaH из А. образуется соед. формулы I, где R=CH2SO2CH3, а при послед. действии KOH в ДМСО-10-гидрокси-9-формилантрацен. При реакции с диметилсульфонийметилидом (CH3)2S=CH2 образуется производное с одним или двумя (формула II) оксирановыми циклами. Из соед. II при восстановлении получают 9,10-диметилантрацен, при действии ВF3-9,10-диформилантрацен. А. с трудом реагирует с гидроксиламином, давая монои диоксимы. Не взаимод. с гидразинами. При действии аналина и AlCl3 превращ. в 9,10-бис-(фениламин).
А. сульфируется 20–40%-ным олеумом: в отсутствие катализатора с образованием последовательно антрахинон-2-сульфокислоты и затем смеси 2,6- и 2,7-дисульфокислот, а в присутствии солей Hg(II)-прреим. с образованием антрахинон-1-сульфокислоты и затем смеси 1,5- и 1,8-дисульфокислот. Т.к. наличие сульфогруппы мало замедляет сульфирование в др. кольцо, получение моносульфокислот ведут до конверсии А. не более 50%. При нитровании азотной кислотой образуется 1-нитроантрахинон с примесью 2-нитроантрахинона, а затем смесь 1,5-, 1,8-динитроантрахинонов (ок. 75%) и 1,6-, 1,7-динитроантрахинонов (ок. 20%). А. хлорируется газообразным Cl2 в H2SO4 или олеуме в присутствии I2, превращаясь в осн. в 1,4,5,8-тетрахлорантрахинон.
В промышленности А. получают:
1. Окислением очищенного антрацена (концентрация 93%) воздухом при 360–380 °C на катализаторах, содержащих V2O5, действием Na2Cr2O7 в 48%-ной H2SO4 или HNO3 в органическом растворителе (уксусной кислоте, нитробензоле, трихлорбензоле), а также окислением сырого антрацена (концентрация 20–30%), который сначала гидрируют в 9,10-дигидроантрацен и затем окисляют кислородом или HNO3 в органическом растворителе.
93%) воздухом при 360–380 °C на катализаторах, содержащих V2O5, действием Na2Cr2O7 в 48%-ной H2SO4 или HNO3 в органическом растворителе (уксусной кислоте, нитробензоле, трихлорбензоле), а также окислением сырого антрацена (концентрация 20–30%), который сначала гидрируют в 9,10-дигидроантрацен и затем окисляют кислородом или HNO3 в органическом растворителе.
2. Взаимод. фталевого ангидрида с бензолом в присутствии AlCl3 в избытке бензола или при размоле в шаровой мельнице без растворителя. После обработки массы разб. H2SO4 образовавшуюся 2-бензоилбензойную кислоту циклизуют в А. нагреванием в концентрированной H2SO4 или олеуме при 110–150 °C.
3. Диеновым синтезом из смеси продуктов окисления нафталина, содержащей 1,4-нафтохинон, и 1,3-бутадиена с послед. окислением полученного 1,4,4а,9а-тетрагидроантрахинона воздухом. Возможен синтез из 1,4-бензохинона и бутадиена (молярное соотношение 1:2).
4. Димеризацией стирола в присутствии H3PO4 в 1-метил-3-фенилиндан с послед, окислением в А. воздухом на ванадиевом кат. или в 2-бензоилбензойную кислоту (HNO3, воздухом в уксусной кислоте в присутствии Со ) и ее циклизацией.
А. применяют для производства антрахиноновых красителей, полициклич. кубовых красителей, бензантрона и др. Мировое производство А. ок. 35 тыс. т/год (1980), большую часть получают окислением антрацена. А. впервые синтезирован О. Лораном в 1835 окислением антрацена азотной кислотой.
Лит.: Горелик М. В., Химия антрахинонов и их производных, М., 1983; Ullmann's Encyclopedic, 4 Aufl., Bd 7, Weinheim, 1974, S. 579; Methoden der organischen Chemie (Houben-Weyl), 4 Aufl., Bd 7/3c, Stuttg., 1979.
М. В. Горелик
Значения в других словарях
- Антрахинон — Органическое соединение, светло-желтые кристаллы, температура плавления 286°С, растворимые в нитробензоле, анилине, горячем толуоле. А. — ароматический дикетон, исходный продукт для получения многих антрахиноновых красителей (См. Большая советская энциклопедия
- антрахинон — орф. антрахинон, -а Орфографический словарь Лопатина
- антрахинон — [гр. уголь + хинон] – химическое соединение, продукт окисления антрацена, жёлтые, трудно растворимые кристаллы; применяется для изготовления ализариновых красок Большой словарь иностранных слов
- АНТРАХИНОН — АНТРАХИНОН — светло-желтые кристаллы, tпл 287 °C. Антрахинон — исходный продукт для синтеза антрахиноновых красителей, которые отличаются яркостью и прочностью окрасок и используются для крашения шерсти, шелка, приготовления красок. Большой энциклопедический словарь
- Антрахинон — I см. Хиноны. II см. Ализарин и Антрацен. Энциклопедический словарь Брокгауза и Ефрона
