Штаудингера реакции
ШТАУДИНГЕРА РЕАКЦИИ
1) синтез иминов взаимод. карбонильных соед. с иминофосфоранами (иминирование);
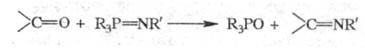
В реакцию вступают альдегиды, кетоны, изоцианаты, кегены, CO2 и др., напр.:
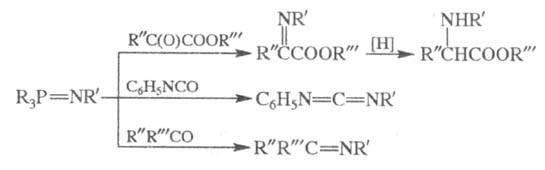
В качестве иминофосфоранов обычно используют соед. с R, R'=Alk, Ar. При взаимодействии R3P = NNH2 с кетонами образуются гидразоны; ароматич. альдегиды и иминофосфораны типа Ar3Р = NN = РAr3 дают азины ArСН = NN = СНAr.
Наряду с иминотриорганилфосфоранами в реакцию вступают иминофосфораны общей формулы X3P = NR (X = OR, Hal) и фосфазины R3P = NN = CR2.
Наиб. легко в Ш. р. вступают карбонильные соед. с кумулир. двойными связями (изоцианаты, кетены); альдегиды и кетоны вступают в реакцию лишь в жестких условиях (напр., смесь бензофенона и PhN = PPh3 выдерживают 40 ч при 150 °C).
Ш. р. обычно проводят в органическом растворителе (напр., ТГФ, бензоле, диэтиловом эфире) или в его отсутствие. Смесь выдерживают при комнатной температуре или нагревают в течение неск. часов или суток. Выходы обычно высокие.
Считают, что Ш. р. осуществляется с образованием на промежут. стадии бетаина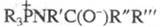 или четырехчленного циклич. аддукта формулы I. Такой механизм во многом аналогичен механизму Виттига реакции.
или четырехчленного циклич. аддукта формулы I. Такой механизм во многом аналогичен механизму Виттига реакции.
В условиях Ш.р. с иминофосфоранами реагируют также тиокарбоиильные соед. (напр., тиокетоны, CS2, изотиоцианаты) и SO2 .
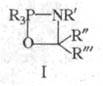
В реакцию, подобную Ш. р., вступают анионы амидофосфатов:
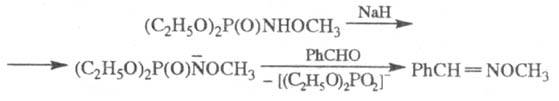
Ш. р. используют в лаб. практике, в т. ч. для синтеза аминокислот [восстановлением RC( = NR')COOR]. Открыта Г. Штаудингером и И. Мейером в 1919.
Лит.: Фосфазосоединения, К., 1965, с. 204–07; Trippett S., "Quart. Rev.", 1963, v. 17, № 3, p. 406–40; Appel P., Siegemund G., "Z. anorg. allg. Chem.", 1968, Bd 363, S. 183–90.
2) Получение иминофосфоранов действием азидов на третичные фосфины:
R3P + R'N3 R3P = NR' + N2
R3P = NR' + N2
R = Alk, AT; R' = H, Alk, Ar, Ac, глюкозил и др.
Алифатич. азиды менее активны, чем ароматич. и ацилазиды; в целом скорость реакции возрастает с увеличением электроотрицательности R'. В арилазидах электронодонорные заместители в пара-положении замедляют, а электроноакцепторные — ускоряют реакцию [напр., n-(CH3)2C6H4K3 реагирует с Ph3P в 23 раза медленнее, чем n-O2NC6H4N3]; триалкилфосфины и фосфины формулы А1кnРAr3-n (n = 1,2) активнее реагируют с азидами, чем Ar3Р. В реакции фосфинов с CF3N3 образующиеся иминофосфораны R3P = NCF3 быстро превращаются в дифторфосфораны R3PF2.
Обычно реакцию проводят в органическом растворителе (напр., диэтиловом эфире, бензоле) при 0–50 °C. Окончание реакции фиксируют по прекращению выделения N2. Выходы высокие (во мн. случаях близки к количественному).
Установлено, что Ш. р. протекает с промежут. образованием продукта присоединения азида к фосфину (в ряде случаев такие аддукты удается выделить). Причем вначале образуются продукты, имеющие строение R3P = NN = NR' или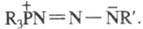 реакцию, подобную Ш. р., с азидами вступают также фосфиты (RO)3P, фосфониты RP(OR)2, хлорфосфины R2PC1 и некоторые др. соед. трехкоординац. атома Р. Однако PH3, PCl3, РhPCl2 в обычных условиях с органилазидами не реагируют.
реакцию, подобную Ш. р., с азидами вступают также фосфиты (RO)3P, фосфониты RP(OR)2, хлорфосфины R2PC1 и некоторые др. соед. трехкоординац. атома Р. Однако PH3, PCl3, РhPCl2 в обычных условиях с органилазидами не реагируют.
Реакцию используют в лаб. практике, открыта Г. Штаудингером и И. Мейером в 1919.
Лит.: Фосфозосоединения, К., 1965, с. 100, 177–79; Leffler J., Temple R., "J. Atner. Chem. Soc.", 1967, v. 89, p. 5235–46.
3) Получение эписульфонов (тиираноксидов) действием SO2 на алифатич. диазосоединения (наз. также реакцией Штаудингера — Пфеннингера):
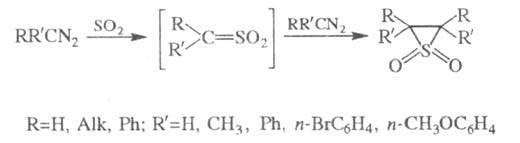
В реакции образуется смесь цис- и транс-изомеров, причем количество цис-изомера увеличивается с ростом полярности растворителя.
Реакцию проводят в среде диэтилового эфира, гексана или CS2 при охлаждении (до −40 °C). Выходы составляют 25–80%. Осн. побочные продукты — кетазины или 1,3,4-тиадиазолидиндиоксиды; возможно также образование олефинов в результате отщепления SO2 от эписульфона при повышенных температурах.
Несимметричные эписульфоны получают взаимод. диазоалканов с сульфохлоридами в присутствии оснований:
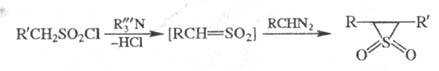
Считают, что в обеих реакциях на промежут. стадии образуется высокореакционноспособный сульфен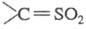 , который связывается с диазоалканом с отщеплением N2.
, который связывается с диазоалканом с отщеплением N2.
Реакцию используют в лаб. практике, открыта Г. Штаудингером и Ф. Пфеннингером в 1916.
Лит.: Inhoffen H. [u. a.], "Annalen", 1966, № 694, S. 19–30; Fischer N., "Synthesis", 1970, № 8, p. 393–404.
Г. И. Дрозд
