Шоттена — Баумана реакция
ШОТТЕНА — БАУМАНА РЕАКЦИЯ
ацилирование спиртов или аминов хлорангидридами карбоновых кислот в присутствии водного раствора щелочи или соды (акцепторов образующегося HCl):
RCOC1 + HOR' + NaOH RCOOR' + NaCl + H2O RCOC1 + H2NR' + Na2CO3
RCOOR' + NaCl + H2O RCOC1 + H2NR' + Na2CO3 RCONHR' + NaCl + CO2 + H2O
RCONHR' + NaCl + CO2 + H2O
В качестве акцепторов HCl применяют также NaHCO3, CaO, MgO, CH3COONa. Ацилирующими агентами обычно являются трудногидролизуемые хлорангидриды ароматич. кислот (напр., бензоилхлорид), а также хлорангидриды высших алифатич. кислот (C10-C18). При ацилировании спиртов выход сложных эфиров повышается с понижением температуры реакции за счет снижения гидролиза хлорангидрида и отчасти эфира. Чтобы избежать местных перегревов, хлорангидрид прибавляют небольшими порциями к раствору спирта в водной щелочи при эффективном перемешивании. Поскольку реакц. среда должна оставаться слабощелочной до конца реакции, хлорангидрид и щелочь берут с 20–25%-ным избытком. Эти же правила применимы и для ацилирования аминов. Выходы 60–95%.
Ацилирование легкогидролизующимися хлорангидридами (COCl2, AlkCOCl) проводят в инертных растворителях (диэтиловый эфир, хлороформ, бензол) в присутствии мелкоизмельченного порошка щелочи или соды.
Аналогично спиртам в реакцию вступают тиолы:
RCOC1 + HSR' + NaOH RCOSR' + NaCl + H2O
RCOSR' + NaCl + H2O
Ш.-Б. р. используют для лаб. и пром. получения разл. сложных эфиров и амидов, напр. бензанилида C6H5NHCOC6H5, в пром. синтезе ПАВ.
Защиту аминогрупп в аминокислотах при синтезе пептидов также осуществляют в условиях Ш.-Б. р. Реакцию применяют в аналит. практике для идентификации хлорангидридов в виде их анилидов и аминов в виде бензоильных производных.
Метод впервые применен К. Шоттеном в 1884 для ацилирования аминов и Э. Бауманом в 1886 для ацилирования спиртов.
Модификация Ш.-Б. р. — метод Айнхорна, в котором вместо щелочи используют пиридин, служащий одновременно растворителем и акцептором HCl:
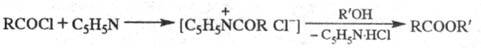
Метод находит широкое применение благодаря мягким условиям синтеза и высокой ацилирующей способности пиридиниевой соли. В ряде случаев вместо пиридина используют третичные амины, напр. (C2H5)3N или (CH3)2NC6H5.
Лит.: Гринштейн Дж., Виниц М., Химия аминокислот и пептидов, пер. с англ., М., 1965; Вейганд К., Хильгетаг Г., Методы эксперимента в органической химии, пер. с нем., М., 1969; Вацуро К. В., Мищенко Г. Л., Именные реакции в органической химии, М., 1976; Sonntag N. О., "Chem. Revs.", 1953, v. 52, № 2, p. 238–399.
С. К. Смирнов
