Хёша реакция
Хёша реа́кция
ХЁША РЕАКЦИЯ (Губена — Хёша реакция, Хеша реакция)
получение ароматич. кетонов путем С-ацилирования многоатомных фенолов (или их эфиров) с помощью нитрилов и HCl, напр.:
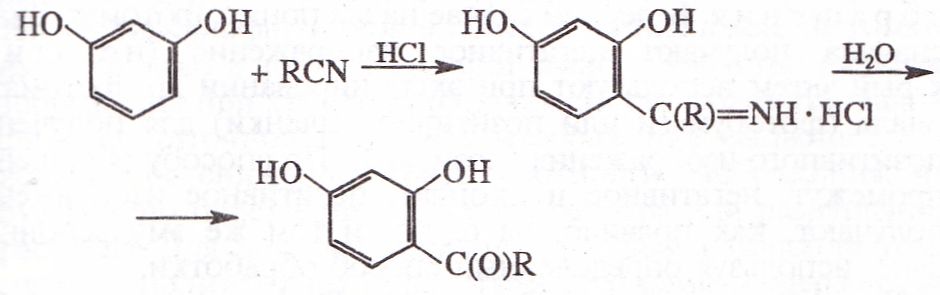
Обычно Х. р. осуществляют в присутствии катализатора [хлориде* Ζη(Π), Fe(HI)1 Co(H), Ni(H), Cu(II), Cd(H)] в среде орг. :-тителя (диэтилового эфира, хлороформа, бензола и др.) при температуре от О до −5 °C (при использовании CH3CN реакцию ведут три температуре ок. 20 °C). Обычно вначале насыщают хлористым ёсдородом смесь нитрила с катализатором и через 2 ч добавляют фенол; образующийся гидрохлорид кетимина отделяют — гидролизуют. Выходы кетонов колеблются в широких доеделах, приближаясь в неосложненных побочными процессами случаях к количественным.
В Х. р. наиб. гладко вступают двух- и трехатомные фенолы а их эфиры; электронодонорные ppmo-заместители способствуют, а электроноакцепторные препятствуют протеканию --■таи; очень низкой реакц. способностью обладают пирокатехин, гидрохинон и его эфиры.
В реакцию вступают алифатич. [в т. ч. содержащие в a-положении группу HO, Hal, RC(O) или RC(O)O], ароматич. и хнрноароматич. нитрилы, а также динитрилы.
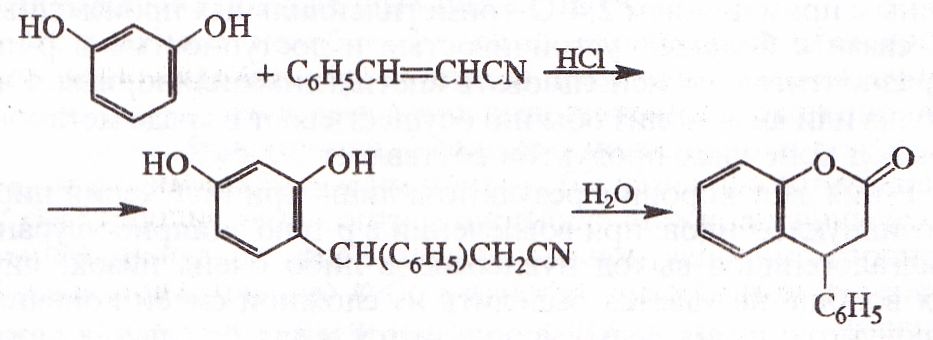
χβ-Ненасыщенные нитрилы и нитрилы, содержащие в ί-ооложении группу HO, Hal или C = О, в условиях Х. р. лавот первоначально β-арилпропионитрилы, которые далее могут превращаться в соответствующие кислоты, а при замыкании цикла в кумарины и дигвдрокумарины (т. наз. аномальная реакция Хеша), напр.:
Осн. побочные процессы — образование иминоэфиров и димеризация нитрилов.
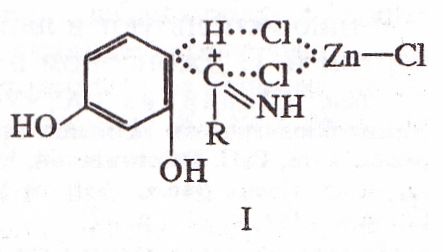
Механизм Х.р. до конца не выяснен. Считают, что в отсутствие катализатора ароматич. соед. подвергается электроф. атаке иммониевым катионом R-C+=NH, а в присутствии катализатора процесс осуществляется через циклич. переходное состояние (формула I). В обоих случаях процесс завершается образованием гидрохлорида кети-мина, гидролиз которого приводит к кетону.
Известно много модификаций Х. р.: получение кетонов из фенолов и нитрилов в присутствии CF3SO2OH (механизм отличен от Х. р.); формилирование ароматич. соед. под действием HCN или Zn(CN)2 (см. Гаттермана синтез) и их цианирование при действии CCl3CN, BrCN или Hg(0NC)2; ацилирование ароматич. аминов с помощью нитрилов в присутствии BCl3 и др.
Х. р. используют в препаративной практике. Она открыта Я. Губеном и Э. Шмидтом в 1913, позднее подробно изучалась К. Хешем.
Лит.: СперриП-Е., Дюбуа A.C.,в сб.: Органические реакции, пер. с англ., сб. 5,M., 1951, с.284–318; ЗильберманЕ.Н.,Реакдиинитрилов,М., 1972, с. 195–293; M ар ч Д ж., Органическая химия, пер. с англ., т. 2, М., 1987, с. 371–72.
Г. И. Дрозд
