Патерно — Бюхи реакция
ПАТЕРНО — БЮХИ РЕАКЦИЯ
фотохим. циклоприсоединение карбонильных соед. к олефинам с образованием оксетанов:
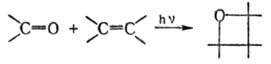
Карбонильными соед. могут быть алифатич. и ароматич. альдегиды и кетоны, a-дикетоны, хиноны, a-кетоэфиры и ацилцианиды, олефины-ациклич. и циклим, соед. с разл. заместителями при двойной связи. Реакцию обычно проводят в апротонном растворителе (напр., в бензоле, гексане) при УФ облучении (λ 360 нм). Выходы оксетанов 60 90%. Осн. побочные продукты — олигомеры и полимеры.
Несимметричные олефины образуют, как правило, смеси изомерных оксетанов, напр.:
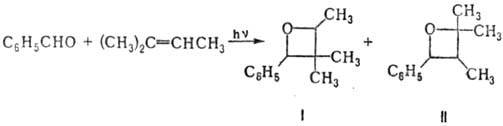
В этой реакции общий выход составляет 64%; выход I в 1,6 раза больше, чем II. При использовании в реакции вместо бензальдегида ацетофенона реакция осуществляется более селективно (смесь содержит ок. 90% оксетана, соответствующего сеод. I).
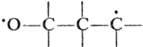
Считается, что ключевая стадия реакции — образование донорно-акцепторного комплекса (эксиплекса) между возбужденной молекулой карбонильного соед. и олефином. Далее эксиплекс преобразуется в бирадикал в n-p*-трип-летном или синглетном состоянии (спектрально обнаружен интермедиат ). В последнем случае оксетановый цикл замыкается быстрее, что предопределяет более высокий выход конечных продуктов. Установлено, что когда энергия триплетного состояния карбонильного соед. сравнима или выше, чем та же величина для олефина, то процесс образования оксетана частично или полностью подавляется, а превалируют побочные реакции.
В реакцию, подобную П.-Б. р., вступают карбонильные соед. с некоторыми ароматич. гетероциклами и кетениминами, напр.:
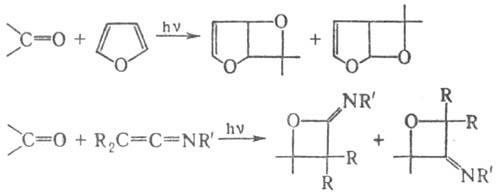
Тиокетоны образуют с олефинами неустойчивые тистаны, которые обычно претерпевают дальнейшие превращ. под действием УФ облучения.
П.-Б. р. широко используют в препаративном синтезе. Реакция открыта в 1909 Э. Патерно и Г. Чиффи, позднее подробно изучалась Я. Бюхи.
Лит.: Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 392–96; Muller L, Hamer J., 1,2-Cycloaddition Reactions, N. Y., 1967; Arnold D., "Adv. Photochem.", 1968, v. 6, p. 301 423; Jones..., "Org. Photochem.", 1981, p. 1–122.
Г. И. Дрозд
