Кёнигса — Кнорра реакция
КЁНИГСА — КНОРРА РЕАКЦИЯ
получение ацилированных О — алкилгликозидов взаимод. ацилгликозилгалогенидов со спиртами или фенолами, напр.:
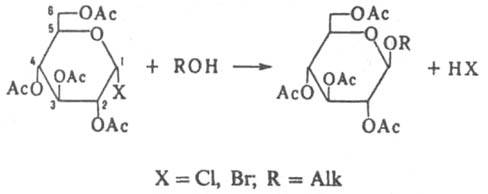
В широком смысле под К. — К. р. понимают аналогичную реакцию гликозилгалогенидов, содержащих разл. образом защищенные гидроксильные группы углеводного остатка. Реакцию проводят в среде спирта — реагента или в инертных растворителях (CHCl3, CH2Cl2, нитрометан, ацетонитрил и др.) при комнатной или несколько повыш. температуре в присутствии катализатора (Ag2O или Ag2CO3) и осушителя (обычно CaSO4). Катализатор одновременно служит акцептором НХ, выделяющегося в реакции. Реакция может протекать с участием ацилоксигруппы (путь а) или по механизму SN2 (путь б), напр.:
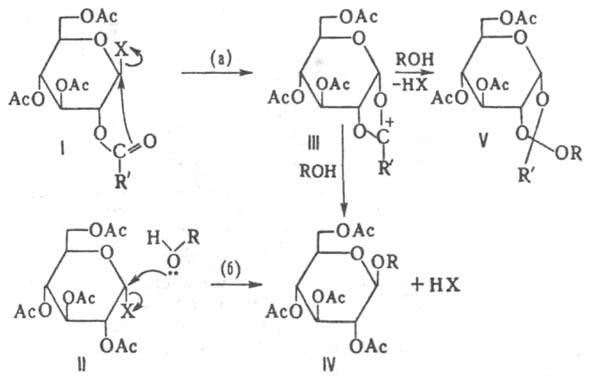
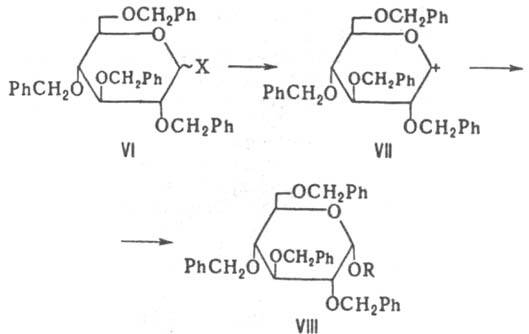
Реализация того или иного пути реакции, а следовательно, и состав продуктов определяются конфигурацией заместителей у атомов С-1 и С-2 в исходном галогениде, характером группы при С-2, природой акцептора НХ, полярностью среды и др. факторами. По пути (а)К.-К. р. 1,2 - транс-ацилгликозилгалогенидов протекает с участием ацилоксигруппы через промежут. катион (III) с образованием 1,2-транс-ацилгликозида (IV) или ортоэфира (V). С 1,2-цис-ацилгликозилгалогенидами (II) реакция идет обычно с образованием 1,2-транс-гликозидов (IV), в некоторых случаях — ортоэфиров. Наличие в исходном соед. (VI) у атома С-2 защитной группы, не участвующей в реакции по С-1 (напр., бензилоксигруплы), дает возможность получать по К. — К. р. 1,2-цис-гликозиды (VIII); при этом реакция протекает через образование гликозил-катиона (VII) по механизму SN1, напр.:
Модификации К.-К. р.: 1) использование в качестве катализатора Hg(COOCH3)2 или Hg(CN)2; реакция протекает в гомог. среде (модификация Гельфериха). В этих условиях из 1,2-цис-ацилгликозилгалогенидов образуется смесь 1,2-цис- и 1,2-транс-гликозидов; 2) использование в качестве катализатора смеси HgO и HgBr2 (модификация Шредера). К. — К. р. — один из основных методов синтеза гликозидов и олигосахаридов. В ряду альдоз К.-К. р. носит достаточно общий характер применительно к синтезу пиранозидов (производных моно- и олигосахаридов); синтез фуранозидов по этой реакции затруднен из-за низкой устойчивости соответствующих галогенидов. Для синтеза гликозидов кетоз (кетозидов) К.-К. р. почти не используется вследствие образования сложной смеси продуктов реакции. Конденсация, аналогичная К.-К. р., была описана А. Михаэлем в 1879 применительно к синтезу арилгликозидов, В. Кёнигсом и Э. Кнорром в 1901 — для гликозилирования спиртов, а также Э. Фишером и Г. Армстронгом в 1901. Традиционно авторство открытия этой р-вдш приписывают В. Кёнигсу и Э. Кнорру.
Лит.: Бочков А. Ф., Афанасьев В. А., Заиков Г Е., Образование и расщепление гликозидных связей. М.. 1978; Igarashi К., "Adv. Garbohydr. Chem. Biochem.", 1977, v. 34, p. 243 83; Восhkоv A. F., Zaikоv G. E., Chemistry of the O-glycosidic bond. Formation and cleavage, Oxf., 1979.
А. Ф. Бочков
