Диаграмма состояния
Диагра́мма состояния
Диаграмма равновесия, фазовая диаграмма, графическое изображение соотношений между параметрами состояния физико-химической системы (температурой, давлением и др.) и её составом. В простейшем случае, когда система состоит только из одного компонента, Д. с. представляет собой трёхмерную пространственную фигуру, построенную в трёх прямоугольных координатных осях, по которым откладывают температуру (Т), давление (p) и мольный объём (v). Пользование объёмной Д. с. неудобно вследствие её громоздкости; поэтому на практике применяют проекцию Д. с. на одну из координатных плоскостей, обычно на плоскость p — Т.
В качестве простейшего примера на рис. изображена (без соблюдения масштаба) Д. с. двуокиси углерода CO2. Любая точка Д. с. (фигуративная точка) изображает состояние CO2 при температуре и давлении, отвечающих этой точке. Точка О (тройная точка) отвечает равновесию трёх фаз — твёрдой, жидкой и газообразной CO2. В точке О пересекаются три кривые: ОА (кривая возгонки), отвечающая равновесиям твёрдой и газообразной CO2; OK (кривая испарения), отвечающая равновесиям жидкой и газообразной CO2; ОВ (кривая плавления) — твёрдой и жидкой CO2. Эти кривые делят плоскость диаграммы на три поля — области существования трёх фаз: твёрдой S, жидкой L и газообразной G. Точка К отвечает критической температуре (См. Критическая температура) CO2 (31,0°С), при которой исчезает различие между свойствами жидкости и газа. Согласно терминологии фаз правила (См. Фаз правило), точке О отвечает нонвариантное равновесие, точкам на кривых ОА, ОВ и ОК — моновариантное равновесие, а точкам на полях S, L и G — дивариантное равновесие. В случае Полиморфизма Д. с. усложняется (число тройных точек равно числу полиморфных превращений). О Д. с. систем, число компонентов которых больше 1, см. в статье Двойные системы.
Экспериментальное построение Д. с. осуществляется различными методами физико-химического анализа, термических и рентгенографических анализов, оптической и электронной микроскопии, дилатометрии, измерения электросопротивления, твёрдости и др. свойств. Правильность построения Д. с. проверяется на основании правила фаз, принципа соответствия и принципа непрерывности. Д. с. широко применяют на практике в металловедении, металлургии, химии и др.; например, Д. с. железо — углерод имеет важное значение для термической обработки стали.
Лит.: Аносов В. Я., Погодин С. А., Основные начала физико-химического анализа, М.—Л., 1947; Аносов В. Я., Краткое введение в физико-химический анализ, М., 1959; Древинг В. П., Калашников Я. А., Правило фаз с изложением основ термодинамики, 2 изд., М., 1964.
С. А. Погодин.
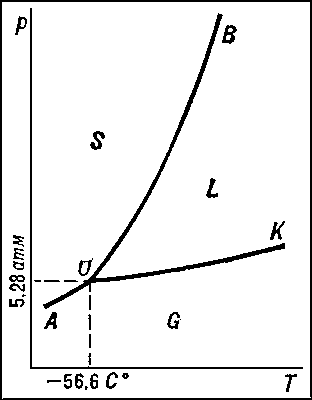
Диаграмма состояния двуокиси углерода CO2.
Значения в других словарях
- ДИАГРАММА СОСТОЯНИЯ — (диаграмма равновесия, фазовая диаграмма), геом. изображение равновесных состояний термодинамич. системы при разных значениях параметров, определяющих эти состояния: темп-ры Т, давления р, состава системы (концентраций компонентов xi)... Физический энциклопедический словарь
- диаграмма состояния — ДИАГРАММА СОСТОЯНИЯ (фазовая диаграмма) графич. изображение всех возможных состояний термодинамич. системы в пространстве осн. параметров состояния температуры Т, давления р и состава х (обычно выражаемого молярными или массовыми долями компонентов). Химическая энциклопедия
- ДИАГРАММА СОСТОЯНИЯ — ДИАГРАММА СОСТОЯНИЯ (фазовая диаграмма) — графическое изображение соотношения между параметрами состояния термодинамически равновесной системы (температурой, давлением, составом и др.). Большой энциклопедический словарь
