Хинолин
C9H7N — был впервые получен Жераром при перегонке хинина и цинхонина с едким кали; он получается вместе с пиридиновыми основаниями. Эти органические основания находятся также и в каменноугольном дегте, как это было указано Гофманом. X. по способу Бутлерова и Вышнеградского получается из цинхонина, для чего его разлагают едким кали при возможно низкой температуре в присутствии окиси меди. В настоящее время X. может быть получен синтетически (см. ниже). X. можно рассматривать как нафталин С10Н8 (см.), в котором вместо группы СН находится атом азота, и потому он стоит в таком же отношении к нафталину, как пиридин C5H5N (см.) к бензолу С6H6, a так как однозамещеных нафталинов может быть два изомера — α и β, то является возможным существование двух изомерных X. — собственно X. и изохинолина:
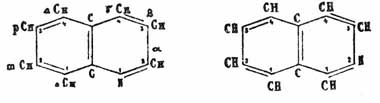
В X. имеются два ядра — одно бензольное, а другое пиридинное; что же касается расположения двойных связей в X. и изохинолине, то большинство ученых признает попеременное расположение двойных и одиночных связей между углеродными атомами, и все соображения, которые высказываются по этому поводу в нафталине (см. соотв. статью), имеют место и здесь. Синтетические способы получения подтверждают принятое строение X. Кенигс получил X. при пропускании аллиланилина над нагретой окисью свинца:
C6H5(С3Н5)NH + О2 = C9H7N + 2Н2О.
Байер получил X. из ортоамидокоричного альдегида отщеплением воды:
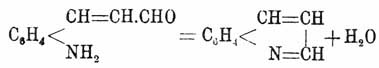
При нагревании анилина с паральдегидом и соляной кислотой образуется α-метил-Х., или хиналдин (Дебнер и Миллер):
C6H5ΝΗ2 + 2С2H4О + О = C10H9N + 3Н2О.
Промежуточным продуктом является этилиденанилин, образующ. из альдегида и анилина:
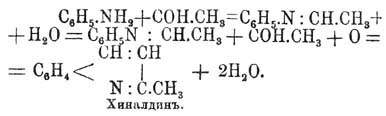
Самым лучшим способом получения X. считается метод Скраупа, который для его получения берет анилин, глицерин, серную кислоту и нитробензол; смесь этих соединений нагревается осторожно до начала бурной реакции, а затем снова нагревается в течение нескольких часов:
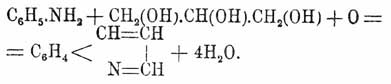
Сначала образуется серно-кислая соль X., которая разлагается едким кали; выделенный X. очищают перегонкой. Нитробензол играет роль окислителя; в качестве промежуточного продукта реакции является, вероятно, акролеин, образующий с анилином акролеинанилин C6H5N:СН.СН:CH2. Гомологи и аналоги анилина дают подобным же образом гомологи и аналоги X. Приведенные способы получения X. показывают, что X. есть ортобидериват бензола, и что в нем азот непосредственно связан с бензольным ядром; точно так же этими реакциями устанавливается существование шестичленного пиридинового кольца, образованного тремя углеродными атомами, атомом азота и двумя углеродами бензольного кольца. Это обстоятельство доказывается окислением X. в пиридиндикарбоновую кисл. (Гогеверф и Фан-Дорп):
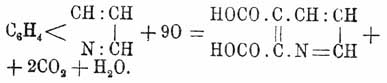
+ 2CO2 + H2O. Три водородных атома пиридинового ядра, считая от азота, обозначаются буквами α, β и γ, а 4 водородных атома бензольного ядра — буквами о, m, p и а (см. выше лев. форм.). Другое обозначение предложено Байером; ядро пиридиновое называется Ру, а бензольное Bz, а атомы водорода обозначаются цифрами 1, 2, 3, 4. Так как ни один из этих водородных атомов не расположен симметрически по отношению к другому, то по теории следует ожидать по семи монодериватов X. Действительно, получено семь изомерных Х.-монокарбоновых кислот. Положение заместителей в X. определяется или: 1) синтезами данного соединения (см. выше синтез метилхинолина) или 2) продуктами окисления; так, Bz-хинолинкарбоновая кислота, в которой карбоксил связан с бензольным ядром, дает пиридиндикарбоновую кислоту, а Ру-хинолинкарбоновая кислота (карбоксил находится в пиридиновом ядре) дает пиридинтрикарбоновую кислоту.
X. представляет бесцветную, сильно преломляющую свет жидкость своеобразного запаха с темп. кип. 236°. Он есть одноатомное основание и образует соли с кислотами; двухромовокислая соль (C9H7N)Cr2O7H2 представляет желтовато-красные иглы, отличается своей трудной растворимостью и является противолихорадочным средством. При окислении X. и его производных бензольное ядро большей частью является менее постоянным, чем пиридиновое; так, X. при окислении дает αβ-пиридиндикарбоновую или хинолиновую кислоту (см. Пиридин); следовательно, разрушается бензольное ядро. Но зато пиридиновое ядро X. легче гидрируется, чем бензольное; так, X. при действии олова и соляной кислоты легко превращается в тетрагидрохинолин C9H11N, дальнейшее же восстановление идет гораздо труднее. Так как X. при соединении с йодангидридами спиртов дает аммонийного типа соединения, напр. C9H7NCH3J, то он представляет третичное основание. Нитрохинолин получается прямым нитрованием X.; бром присоединяется к X. и дает продукт C9H7NBr2. Хлоропроизводные X. получаются по способу Скраупа, т. е. из хлоранилинов, нитробензола, глицерина и серной кислоты. Нитрохинолины при восстановлении переходят в аминохинолины. Гомологи X. могут быть двух родов, смотря по тому, в бензольное или пиридиновое ядро будет введена замещающая группа; в первом случае будут получаться гомологи X., которые называются толухинолинами и пр.; во втором случае, т. е. при введении в пиридиновое ядро, получатся гомологи, которые называются как замещенные производные того или другого X. Толухинолины C9H6(CH3)N получены Скраупом из толуидинов, нитротолуолов, глицерина и серной кислоты. Все они жидки, причем метасоединение кипит при 260°, орто- — при 248° и парасоединение — при 258°. Гомологи X. представляют основания и дают те же производные, как и X. К окислителям они относятся таким образом, что хромовая кислота в серно-кислом растворе окисляет боковую цепь, образуя хинолинкарбоновые кислоты, а марганцово-калиевая соль окисляет, наоборот, бензольное ядро, переводя их в пиридинкарбоновые кислоты. Важнейшим из гомологов X. второго рода является α-метилхинолин, или хиналдин C10H9N, способ получения которого уже указан выше. Он находится в каменноугольной смоле и представляет бесцветную жидкость, запахом напоминающую хинолин и кипящую при 246°. Водород метиловой группы у хиналдина легкоподвижен; со фталевым ангидридом хиналдин реагирует, образуя красивый желтый пигмент — хинолиновый желтый С10Н7N(СО)2С6Н4 (см.). При замене водорода в X. группой OH получаются оксихинолины C9H6(OH)N, которые обладают различными свойствами, смотря по положению водного остатка в бензольном или пиридинном ядре. Хинофенолы, т. е. такие оксихинолины, в которых гидроксил находится в бензольном ядре, получают по способу Скраупа, действуя глицерином и серной кислотой на смесь амидо- и нитрофенолов. Иначе хинофенолы можно получать сплавлением хинолинсульфокислот с едким кали или распадением оксихинолинкарбоновых кислот. Они, подобно X., способны образовать соли и при действии едкого кали и йодистых алкилов дают смешанные простые эфиры, а при действии хлорангидридов кислот — сложные эфиры. Так, метиловый эфир Bz-(3)-оксихинолина C9H6(OCH3)N называется хинанизолом и кипит при 305°. Он был получен Бутлеровым и Вышнеградским при действии едкого кали на хинин. К числу оксихинолинов, у которых гидроксил находится в пиридинном ядре, относится основание, называемое карбостирилом (см.). X. водородом в момент выделения превращается в дигидрохинолин C9H9N, с т. пл. 161°, а затем в тетрагидрохинолин C9H11N4 или
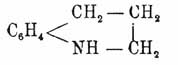
который представляет жидкость с темп. кип. 245°. При дальнейшем присоединении водорода, которое идет с трудом, гидрируется бензольное кольцо и получается декагидрохинолин C9H18N, с темп. пл. 48° и темп. кип. 204°. Если в X. вместо водородов будут стоять карбоксилы, то получаются хинолинкарбоновые кислоты, причем у них карбоксил может стоять в пиридинном или бензольном ядре. Хинолинкарбоновая кислота, или цинхониновая кислота
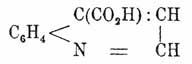
принадлежит к первой категории. Она получается при окислении цинхонина. Когда карбоксил помещается в бензольном ядре, то получаются хинолинбензкарбоновые кислоты, которые были получены Скраупом при действии на соответствующие амидобензойные и нитробензойные кислоты глицерином и серной кислотой. Оксихинолинам отвечают оксихинолинкарбоновые кислоты; они получаются при нагревании с едким кали сульфоцинхониновых кислот C6H5 (SO2H)(COOH)N. При окислении хинина хромовой кисл. получается хининовая кисл. С9Н5(СН3О) (СООН), которая есть метиловый эфирэфир ксантохиновой (параоксихинолин-γ-карбоновой) кислоты С9Н5(ОН)(СООН)N.
Изохинолин в отношении строения отличается от X. только положением атома азота, как это было уже указано выше. Изохинолин найден был Гогеверфом и Фан-Дорном в каменноугольной смоле вместе с X. и был отделен от него посредством кристаллизации его серно-кислой соли. Изохинолин плавится при 23° и кипит при 240,5°; во всем сходен с X., но только представляет более сильное основание. Синтетически он получается из β-нафтохинона, который обрабатывается хлорной известью или хлорноватистой кислотой, причем получаются диоксинафтохинон и изокумаринкарбоновая кисл. Последняя с аммиаком дает изокарбостирилкарбоновую кисл., представляющую производное изохинолина, из которой последний получается перегонкой с цинковой пылью (Бамбергер и Цинке):
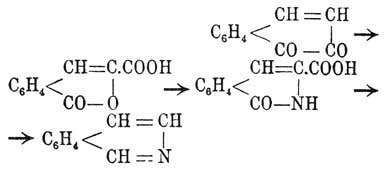
Изохинолин получается также из имида гомофталевой кислоты при нагревании с цинковой пылью:
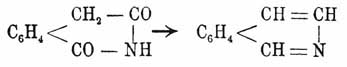
При окислении хамелеоном изохинолин дает фталевую кислоту, причем карбоксилы образуются на счет углеродов пиридинного кольца, и βγ-пиридиндикарбоновую кислоту, причем карбоксилы происходят на счет углеродов бензольного ядра. Изохинолин дает такие же производные, как и X.
В. Ипатьев. Δ.
Аналоги X. — нафтохинолины С13Н9N, антрахинолины С17Н11N, фенантролины C12H6N2 и пр. получаются, если в синтезах по способам Скраупа и Дебнера-Миллера (см. выше) анилин заменять соответственно α- и β-нафтиламинами, антраминами, фенилендиаминами, амидохинолинами и пр.; при этом присоединение пиридинного кольца вообще происходит к той паре атомов углерода бензольного ядра, которая, согласно схеме Кекуле, связана двойной связью — обстоятельство, говорящее, между прочим, против различных предложенных для бензола и пиридина центрических и диагональных формул. α-Нафтохинолин (темп. пл. 52°, т. кип. 338°)имеет строение
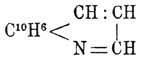
а β-нафтохинолин (темп. пл. 93°) —
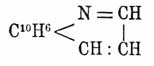
Интересно характерное изменение свойств гидронафтохинолинов в зависимости от того, какие из колец нафтохинолина подвергаются гидрогенизации. Если гидрогенизуется пиридиновое кольцо, то получаемые тетрагидронафтохинолины С10Н6:NC3H7 обладают свойствами алкилированных нафтиламинов; при гидрогенизации одновременно пиридинового и внешнего бензольного кольца нафталинового ядра получаются октогидронафтохинолины C4H8:C6H2:NC3H7, обладающие характером алкилированных (в ядре и при азоте) анилинов; наконец, из β-нафтохинолина при гидрировании пиридинового и соседнего с ним бензольного кольца нафталинового ядра образуется октогидронафтохинолин строения
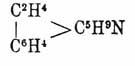
с жирноиминным характером пиперидина (cp. Нафтиламины). Антрахинолин
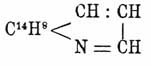
(темп. пл. 170°, темп. кип. 446°) получен Гребе перегонкой с цинковой пылью ализариновой сини (см. Краски органические искусств.), представляющей диоксиантрахинонхинолин
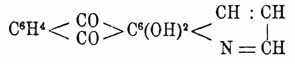
растворы антрахинолина обладают интенсивной синей флуоресценцией. В то время, как нафто- и антрахинолины содержат по 1 атому азота и представляют, как это видно из формул, продукты конденсации одного пиридинового кольца с нафталиновым и антраценовым, в фенантролинах имеется несколько иной случай. Они содержат 2 атома азота и представляют строение фенантрена (см.), в двух из числа трех бензольных колец которого по одной группе СН замещено атомами азота; их можно также рассматривать как X., к которому примкнуло еще одно пиридиновое кольцо. Если последнее примыкает к бензольному кольцу X., то получаются собственно фенантролины C3H3N:C6H2:NC3H3 (орто-, мета- и пара- — смотря по взаимному положению атомов N), при примыкании же его к пиридиновому кольцу получается хинохинолин C6H4:C3HN:C3H3N, напр., полученный из γ-амидохиналдина по методу Скраупа α-метил-γ-хинохинолин С6H4:С3(CH3)N:C3H3N (темп. пл. 207°, темп. кип. 360°).
П. П. Рубцов. Δ.
Значения в других словарях
- Хинолин — 2,3-бензопиридин, гетероциклическое соединение; бесцветная жидкость с характерным сладковатым запахом, tkип 238°C; плохо растворим в воде, хорошо — в спирте, эфире. Большая советская энциклопедия
- хинолин — орф. хинолин, -а Орфографический словарь Лопатина
- хинолин — ХИНОЛИН мол. м. 129,15; бесцветная жидкость с запахом пиридина, во влажном воздухе на свету желтеет; т. пл. −15,2 °C, т. кип. 236,6 °C, 108,8/10 мм рт. ст. Химическая энциклопедия
- хинолин — хинолин , -а Орфографический словарь. Одно Н или два?
- хинолин — [< перуанск. kina кора] – производное бензола; находится в каменноугольной смоле; бледножёлтая маслянистая жидкость со жгучим горьким вкусом; применяется в органическом синтезе; некоторые соли применяются в медицине как антисептики Большой словарь иностранных слов
- ХИНОЛИН — ХИНОЛИН — бесцветная жидкость, tкип 237 °С. Содержится вместе с изохинолином в каменноугольной смоле. Производные хинолина применяются как лекарственные средства, напр. атофан (цинхофен) — энтеросептол, хинозол. Большой энциклопедический словарь
