ЗАКОНЫ СОХРАНЕНИЯ
ЗАКОНЫ СОХРАНЕНИЯ, физические законы, согласно которым некоторое свойство замкнутой системы остается неизменным при каких-либо изменениях в системе. Самыми важными являются законы сохранения вещества и энергии. Закон сохранения вещества утверждает, что вещество не создается и не разрушается; при химических превращениях общая масса остается неизменной. Общее количество энергии в системе также остается неизменным; энергия только преобразуется из одной формы в другую. Оба эти закона верны лишь приблизительно. Масса и энергия могут превращаться одна в другую согласно уравнению Е = тс2. Неизменным остается лишь общее количество массы и эквивалентной ей энергии. Еще один закон сохранения касается электрического заряда: его также нельзя создать и нельзя уничтожить. В применении к ядерным процессам закон сохранения выражается в том, что общая величина заряда, спин и другие КВАНТОВЫЕ ЧИСЛА взаимодействующих частиц должны остаться такими же у частиц, возникших в результате взаимодействия. При сильных взаимодействиях все квантовые числа сохраняются. При слабых взаимодействиях некоторые из требований этого закона нарушаются, особенно в отношении ЧЕТНОСТИ.
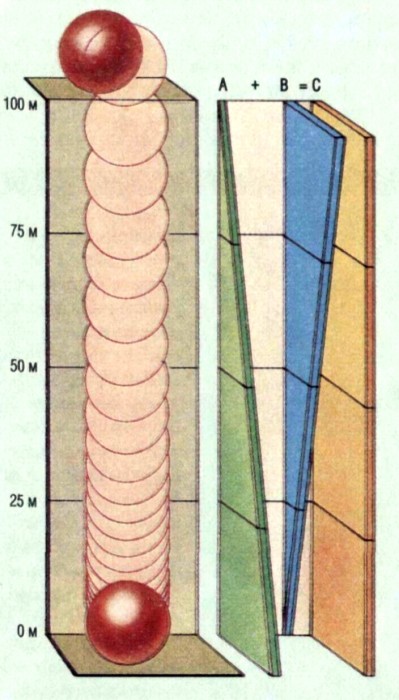
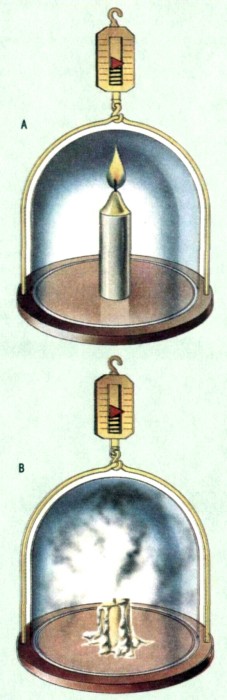
Закон сохранения энергии можно объяснить на примере падения шара весом 1 кг с вы соты 100 м. Начальная общая энергия шара — это ею потенциальная энергия. Когда он падаег, погенциальная энергия постепенно убывает а кинетическая нарастает, но общее копичество энергии остается неизменным Таким образом, имеет место сохранение энергии. А — кинетическая энергия возрастает от 0 до максимума: В -— потенциальная энергия уменьшается от максимума до нуля; С -— общее количество энергии, которое равно сумме кинетическом и потен Закон сохранения вещества, утверждает, что в ходе химических реакций вещество не создается и не исчезает. Это явление можно продемонстрировать при помощи класси ческого опыта, при котором производится взвешивание свечи, горящей под стеклянным колпаком (А). В конце опыта вес колпака и его содержимого остаегся таким же, каким был в начале, хотя свеча, вещество которой состоит в основном из углерода и водорода, «исчезла», поскольку из нее выделились летучие продукты реакции (вода и углекислый газ). Только после того, как в конце XVIII в ученые признали принцип сохранения вещества, стал возможен количественных подход к химии.
