1,2-диоксетан
1,2-ДИОКСЕТАН
соед. формулы I, мол. м. 60,03. Незамещенный Д. неустойчив; наиб. изучены его тетраалкилпроизводные, а также 1,2-диоксетаноны и 1,2-диоксетандион (формулы соотв. II и III).
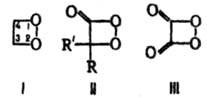
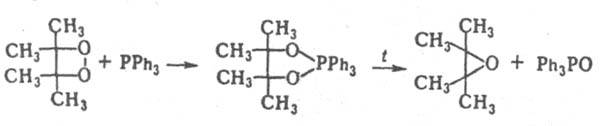
Большинство производных Д. — кристаллы, стабильные при комнатной температуре. Раств. в хлороформе, бензоле, нитрометане. По химическим свойствам — типичные пероксиды (см. пероксидные соединения органические). Под действием LiAlH4 тетраалкилпроизводные Д. восстанавливаются в 1,2-диолы, что используют для их аналит. определения. При реакции с PPh3 превращаются в циклич. фосфорамы, разлагающиеся при нагр. в эпоксиды, напр.:
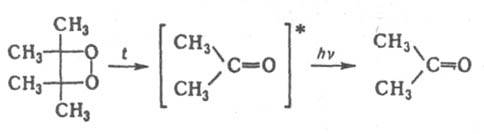
Производные Д. легко подвергаются разложению. Термолиз их растворов в органических растворителях сопровождается хемилюминесценцией в результате дезактивации образующихся возбужденных молекул кетонов (обозначены звездочкой), находящихся в триплетом состоянии, напр.:
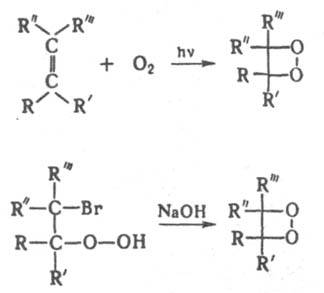
Тетраалкилпроизводные Д. получают фотоокислением олефинов или циклизацией α-бромгидропероксидов, напр.:
Соед. II получают циклизацией α-пергидроксикислот RR'C(OOH)COOH в присутствии дициклогексилкарбодиимида. Соед. II образуются также в процессе биосинтеза в светляках, некоторых морских организмах и растениях. Их распад вызывает биолюминесценцию ("холодное свечение"). Соед. Ш получают действием конц. H2O2 на оксалилхлорид в присутствии оснований (в чистом виде не выделено). Д. и его производные — промежут. продукты окисления мн. непредельных соед. биол. природы.
Лит.: Антоновский В. Л., Бузланова М. М., Аналитическая химия органических пероксидных соединений, М., 1978; Васильев Р. Ф., в сб.: Химия органических пероксидов, Волгоград, 1982, с. 75–91; Adam W., "Adwances in Hetcrocyclic Chemistry", 1977, v.21, p. 437–81; Horn A. [a.o.], "Molecular Photochemistry", 1978 79, v. 9, № 1, p. 1–34.
В. Л. Антоновский
