этилендиамин
ЭТИЛЕНДИАМИН (1,2-диаминоэтан) H2NC2H4NH2
мол. м. 60,099; бесцветная жидкость с аминным запахом, дымящая на воздухе; т. пл. 10,9 °C, т. кип. 117 °C; 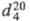 0,8966;
0,8966; 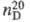 1,4571;
1,4571; 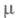 6,34∙10−30 Кл∙м;
6,34∙10−30 Кл∙м; 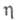 1,35 мПа∙с (25 °C); давление пара 1,21 кПа (20 °C);
1,35 мПа∙с (25 °C); давление пара 1,21 кПа (20 °C); 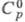 3,41 Дж/(г∙К);
3,41 Дж/(г∙К); 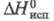 636,4 Дж/г; pК1 3,83, рК2 6,56; образует с водой азеотропную смесь (81,6% по массе Э., т. кип. 119 °C); смешивается с водой (с разогревом) и с большинством орг. растворителей, не раств. в углеводородах.
636,4 Дж/г; pК1 3,83, рК2 6,56; образует с водой азеотропную смесь (81,6% по массе Э., т. кип. 119 °C); смешивается с водой (с разогревом) и с большинством орг. растворителей, не раств. в углеводородах.
Э. обладает хим. свойствами диаминов. С кислотами образует два ряда солей, с металлами (Cu, Mn, Со и др.) — комплексные соли. Нитрат Э. при нагр. отщепляет две молекулы воды с образованием взрывчатого вещества — этилендинитрамина:
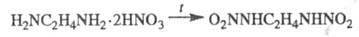
Нагревание Э. с одноосновными карбоновыми кислотами приводит к моно- и диамидам, способным циклизоваться в имидазолины и имидазолидины; аналогично протекают реакции с HCN и альдегидами, напр.:
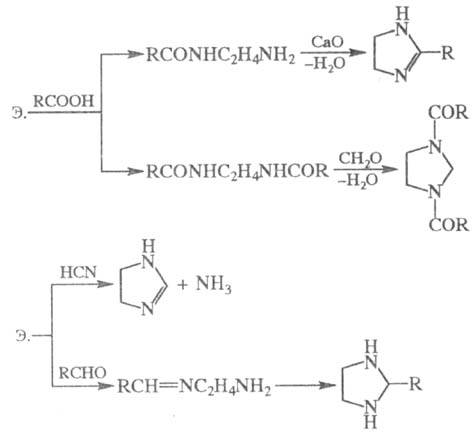
Самоконденсация Э. при повышенных температуре и давлении в присутствии катализатора дает пиперазин, конденсация Э. с 1,2-дикетонами — 2,3-дигидропиразины, с мочевиной -2-имидазолидинон (этиленмочевину).
При взаимодействии Э. с ClCH2COOH или со смесью CH2O и HCl образуется этилендиаминтетрауксусная кислота.
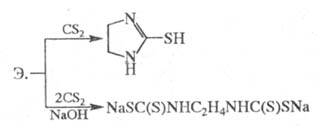
Реакция Э. с 1 эквивалентом CS2 приводит к 2-меркаптоимидазолину, с 2 эквивалентами CS2 в присутствии щелочи — к этилен-бис- (дитиокарбамату):
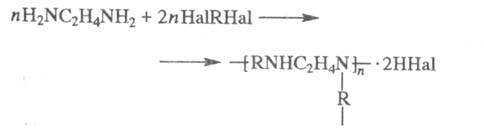
С алкилгалогенидами Э. дает моно- и дизамещенные продукты, с дигалогенидами образуются катионные полимерные продукты (водорастворимые или гелеобразные), напр.:
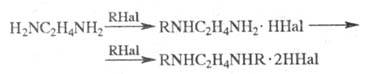
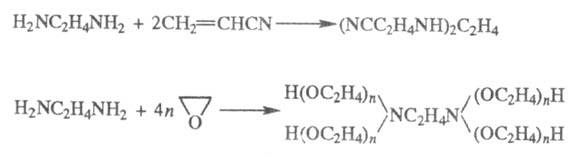
Э. цианэтилируется акрилонитрилом, оксиалкилируется эпоксидами с образованием проксаминов, напр.:
Получают Э. взаимод. дихлорэтана с NH3 (жидким или водным) при 100 °C либо каталитич. гидрированием смеси моноэтаноламина с NH3 при 150–230 °C.
Э. образуется также непосредственно из этилена и NH3 либо из CH2O, NH3 и HCN в присутствии катализатора.
Э. — компонент пластификаторов феноло-формальдегидных смол, полиуретановых волокон, используется для стабилизации смазочных масел и каучуковых латексов, в производстве полиуретанов и термопластичных адгезивов, для получения этилендиаминтетрауксусной кислоты, фунгицидов (напр., цинеба, полимарцина), присадок к моторным маслам, лекарственных средств и др.
Э. раздражает слизистые оболочки верхних дыхат. путей и кожу, поражает печень. ПДК в атм. воздухе 0,03 мг/м3, в воздухе рабочей зоны 2 мг/м3, в воде водоемов хозяйств.-бытового пользования 0,2 мг/м3.
Т. всп. 33 °C, т. самовоспл. 390 °C, КПВ 3,82–19,6%.
Лит.: Вредные вещества в промышленности, 7 изд., т. 2, Л., 1976, с. 232–33; Ullmann's Encyclopedia, 5 ed., Bd A2, Weinheim, 1985, p. 23–26.
П. А. Гембицкий
Значения в других словарях
- Этилендиамин — 1,2-диаминоэтан, H2NCH2CH2NH2, бесцветная жидкость с аммиачным запахом; tkип 116,5°С, tпл 8,5°С, плотность 0,899 г/см3 (20°С); растворим в воде, спирте, хуже — в эфире, нерастворим в бензоле. Сильное основание. Соли... Большая советская энциклопедия
- Этилендиамин — Или диаминоэтан H2N—CH2—CH2—NH2 — относится к аминам гликолей. Получается при восстановлении циана (нитрила щавелевой кислоты) оловом и соляной кислотой: NC.CN + 4H2 = H2N.CH2.CH2.NH2. Бромистоводородная соль... Энциклопедический словарь Брокгауза и Ефрона
