электроотрицательность
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
величина, характеризующая способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А — В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А.
Л. Полинг предложил (1932) для количеств. характеристики Э. использовать термохим. данные об энергии связей А—А, В — В и А — В — соотв. ЕАА, Евв и ЕАВ. Энергия гипотетической чисто ковалентной связи А — В (Еков) принимается равной среднеарифметич. или среднегеометрич. значению величин EAA и ЕВВ. Если Э. атомов А и В различны, то связь А — В перестает быть чисто ковалентной и энергия связи ЕАВ станет больше Ековна величину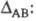
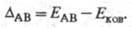
Чем больше различие Э.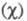 атомов А и В, тем больше величина
атомов А и В, тем больше величина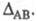 Используя эмпирич. формулу
Используя эмпирич. формулу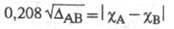 (множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение Э.
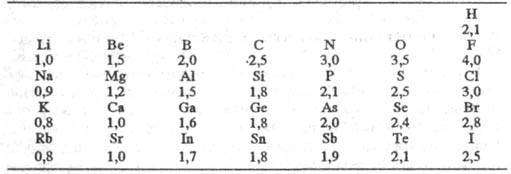
(множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение Э.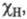 равное 2,1, Полинг получил удобную шкалу относит. числовых значений Э., часть которых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов — F, наименее — тяжелые щелочные металлы.
равное 2,1, Полинг получил удобную шкалу относит. числовых значений Э., часть которых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов — F, наименее — тяжелые щелочные металлы.
Для количеств. описания Э., помимо термохим. данных, используют также данные о геометрии молекул (напр., метод Сандерсона), спектральные характеристики (напр., метод Горди).
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ АТОМОВ ПО ПОЛИНГУ
Широко используют также шкалу Оллреда и Рокоу, в которой Э. рассчитывают по формуле:
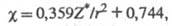
где Z* — т. наз. эффективный заряд ядра по Слэйтеру, r — атомный ковалентный радиус. Наиб. ясный физ. смысл имеет метод Малликена, который определил Э. атома как полусумму его сродства к электрону и потенциала ионизации. Получены шкалы Э. для разл. валентных состояний атомов, для ионов, молекул и групп атомов. Э., базирующиеся на методе Малликена и распространенные на широкий круг разнообразных объектов, наз. абсолютными Э. Для практич. расчетов предложены шкалы Э. Бацанова и Луо-Бенсона.
Величины Э. широко применяют в физ.-хим. исследованиях благодаря наличию простых эмпирич. формул, связывающих Э. с длиной, частотой колебаний, полярностью и др. характеристиками хим. связей. Например, формула Шомакера — Стивенсона связывает длину связи (rАВ) с ковалентными радиусами атомов (rА> rв) и их Э.:
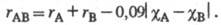
Лит.: Бацанов С. С., Электроотрицательность элементов и химическая связь, Новосиб., 1962; Хьюи Дж., Неорганическая химия, пер. с англ., М., 1987; Филиппов Г.Г., Горбунов А. И., "Росс. хим. журнал", 1995, т. 39, № 2, с. 39–42; Pauling L., The nature of the chemical bond, 3 ed., Ithaca (N. Y.), 1960; Pearson R.G., "horg. Chem.", 1988, v. 27, № 4, p. 734–40; Luo Yu-Ran, В en son S.W., "Ace. Chem. Res." 1992, v. 25, № 8, p. 375–81.
И. П. Ромм
Значения в других словарях
- Электроотрицательность — Атома, величина, характеризующая способность атома в молекуле притягивать электроны, участвующие в образовании химической связи. Известно несколько способов вычисления Э. Так, согласно Р. Малликену (1935), мерой... Большая советская энциклопедия
- электроотрицательность — орф. электроотрицательность, -и Орфографический словарь Лопатина
