цинк
ЦИНК (лат. Zincum) Zn
хим. элемент II гр. периодической системы; ат. н. 30, ат. м. 65,39. Природный Ц. состоит из 5 стабильных нуклидов: 64Zn (48,6%), 66Zn (27,9%), 67Zn (4,1%), 68Zn (18,8%) и 70Zn (0,6%). Известен ряд радиоактивных нуклидов, важнейший из них — 65Zn с Т1/2 244 сут. Конфигурация внеш. электронных оболочек атома 3d104s2; степень окисления + 2; энергия ионизации при последоват. переходе от Zn0 к Zn3+ 9,39, 17,96 и 39,70 эВ; сродство к электрону 0,09 эВ; электроотрицательность по Полингу 1,66; атомный радиус 0,139 нм, ионный радиус (в скобках указано коорди-нац. число) Zn2+ 0,060 нм (4), 0,068 нм (5), 0,0740 нм (6), 0,090 нм (8).
Содержание Ц. в земной коре 7∙10−3 % по массе, в воде морей и океанов 0,01 мг/л. Известно более 70 минералов Ц., из них важнейшие: сфалерит (цинковая обманка) — кубич. модификация ZnS, его светлая разновидность — клейофан, черная — марматит; вюрцит (вюртцит) — гексагон. модификация ZnS; смитсонит ZnCO3; каламин Zn4(OH)2Si2O7 хH2O; цинкит ZnO; виллемит Zn2SiO4; франклинит ZnFe2O4. Минералы Ц. обычно ассоциируются с минералами Pb и Cu в полиметаллич. рудах. Постоянные спутники Ц. в рудах — рассеянные элементы — Cd, In, а также Ge, Ga, Tl.
Свойства. Ц. — голубовато-белый металл. Кристаллич. решетка гексагон. плотноупакованная, а — 0,26649 нм, с = 0,49468 нм, z = 2, пространственная группа С6/mmm; т. пл. 419,58 °C, т. кип. 906,2 °C; плотн. 7,133 г/см3; 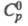 25,4 Дж/(моль∙К);
25,4 Дж/(моль∙К);  7,2 кДж/моль,
7,2 кДж/моль, 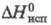 115,3 кДж/моль,
115,3 кДж/моль, 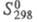 41,6 Дж/(моль∙К); уравнения температурной зависимости давления пара: lg p (мм рт. ст.) = 10,084 —6910/T + 0,192 lg Т+ 0,524 x 10−2 (298 — 692,7К), lg p (мм рт. ст.) = 8,242 — 6294/T — 0,015 lg Т (692,7 — 1164К); температурный коэф. линейного расширения 25,0∙10−6 (273 — 373К); теплопроводность 116,0 Вт/(м∙К); ρ 5,92 мкОм∙см, температурный коэф. ρ 3,7∙10−3К−1 (298-398К). Ниже 0,825 К Ц. — сверхпроводник. Диамагнитен, магн. восприимчивость −0,175∙10−9. Модуль упругости Ц. 99,2 ГПа (293К);
41,6 Дж/(моль∙К); уравнения температурной зависимости давления пара: lg p (мм рт. ст.) = 10,084 —6910/T + 0,192 lg Т+ 0,524 x 10−2 (298 — 692,7К), lg p (мм рт. ст.) = 8,242 — 6294/T — 0,015 lg Т (692,7 — 1164К); температурный коэф. линейного расширения 25,0∙10−6 (273 — 373К); теплопроводность 116,0 Вт/(м∙К); ρ 5,92 мкОм∙см, температурный коэф. ρ 3,7∙10−3К−1 (298-398К). Ниже 0,825 К Ц. — сверхпроводник. Диамагнитен, магн. восприимчивость −0,175∙10−9. Модуль упругости Ц. 99,2 ГПа (293К);  70–100 МПа; относит, удлинение 20–60%; твердость по Бринеллю для отожженного образца 412 МПа. При комнатной температуре Ц. хрупок, при 100–150 °C становится пластичным и прокатывается в тонкие листы и проволоку, при 200–250 °C становится очень хрупок, м. б. истолчен в порошок.
70–100 МПа; относит, удлинение 20–60%; твердость по Бринеллю для отожженного образца 412 МПа. При комнатной температуре Ц. хрупок, при 100–150 °C становится пластичным и прокатывается в тонкие листы и проволоку, при 200–250 °C становится очень хрупок, м. б. истолчен в порошок.
ХАРАКТЕРИСТИКА НЕКОТОРЫХ СОЕДИНЕНИЙ ЦИНКА
таблица в процессе добавления
а Температура полиморфного перехода 880 °C. б Температура разложения. β= 105,13°. При 940 °C переходит в другую моноклинную форму.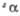 = 94,18°,
= 94,18°, 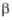 = 91,12е,
= 91,12е, 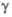 = 92,6°.
= 92,6°.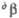 = 89,5°.
= 89,5°.
Стандартный электродный потенциал Ц. −0,76 В. Компактный Ц. тускнеет на воздухе, покрываясь тонким слоем цинка оксида, влажный воздух, особенно в присутствии CO2, постепенно разрушает Ц. при комнатной температуре. При сильном нагр. на воздухе Ц. сгорает с образованием ZnO. Пары воды при красном калении реагируют с Ц. с выделением H2. Ц. обычной чистоты легко взаимод. с кислотами с образованием солей и с растворами щелочей с образованием гидроцинкатов, напр. Na2[Zn(OH)4], раств. в растворах NH3 и солей аммония, FeCl3, вытесняет Cu, Cd и др. более электроположит. металлы из растворов их солей. Ц. высокой чистоты почти не реагирует ни с кислотами, ни с растворами щелочей. Ц. не взаимод. с H2, но H2 незначительно раств. в Ц. при повышенных температурах. Электролитич. Ц. может содержать до 1 см3 H2 на 1 г металла. Гидрид ZnH2 получают косвенными методами, напр. действием LiA1H4 на Zn(CH3)2 в диэтиловом эфире; устойчив в отсутствие влаги, медленно разлагается водой, быстро — кислотами; не раств. в эфире. С N2 Ц. не реагирует, с NH3 при 550–600 °C образует нитрид Zn3N2, который устойчив на воздухе, разлагается водой.
С галогенами выше температуры плавления (в присут. паров воды — при комнатной температуре) Ц. образует цинка галогениды, с халько-генами при нагр. — цинка халькогениды. Кипящий Ц. растворяет незначит. количество углерода. Сообщения о синтезе карбида действием ацетилена на Ц. не подтвердились, но получены тройные карбиды, напр. Ni3ZnC. Растворимость Si в металлич. Ц. 0,06% при 600 °C и увеличивается с ростом температуры. Силициды Ц., как и бориды, неизвестны. В расплавленном Ц. растворяется до 15% Р. При действии паров Р на Ц. при нагр. образуются фосфиды Zn3P2 и ZnP2. Получены арсениды аналогичного состава, при сплавлении c Sb — антимониды Zn3Sb2, Zn4Sb3 и ZnSb. Все соед. Ц. с Р, As и Sb — полупроводники.
Соли Ц. бесцветны, если не содержат окрашенных анионов. В растворах они сильно диссоциированы, растворы имеют кислую реакцию вследствие гидролиза. При действии растворов щелочей и NH3 осаждаются, начиная с pH~5, гидроксосоли, напр. Zn2(OH)2SO4, переходящие в гидроксид Zn(OH)2, который раств. в избытке осадителя.
Для Ц. характерны комплексы с NH3. Сухие соли Ц. поглощают до 6 молекул NH3. Гидроксид и соли Ц. раств. в растворах NH3 с образованием комплексных катионов, содержащих от 1 до 6 молекул NH3. Комплексные аммиакаты хорошо раств. в воде, из растворов в кристаллич. виде выделены гл. обр. [Zn(NH3)2]X2 и [Zn(NH3)4]X2. Труднорастворимый цианид Zn(CN)2 с избытком цианидов щелочных металлов образует легко растворимые комплексы M2[Zn(CN)4] и M[Zn(CN)3], сульфит — комплексы M2[Zn(SO3)2]. Хорошо растворимые в воде тиосульфат и тиоцианат Ц. дают соотв. комплексы [Zn(S203)2]2- и [Zn(SCN)4]2-.
Фосфид Zn3P2 (табл.) разлагается горячей водой и кислотами с выделением PH3; зооцид (родентицид). Антимонид ZnSb — полупроводник с шириной запрещенной зоны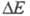 0,61 эВ; в воде и органических растворителях не раств., медленно реагирует с минеральными кислотами; монокристаллы выращивают направленной кристаллизацией, зонной плавкой или вытягиванием по Чохральскому; материал для термоэлектрич. генераторов.
0,61 эВ; в воде и органических растворителях не раств., медленно реагирует с минеральными кислотами; монокристаллы выращивают направленной кристаллизацией, зонной плавкой или вытягиванием по Чохральскому; материал для термоэлектрич. генераторов.
Кобальтат (зелень Ринмана) состава от ZnCo2O4 до ZnCoO2 — зеленые кристаллы со структурой типа шпинели; получают спеканием оксидов или прокаливанием совместно осажденных гидроксокарбонатов; пигмент для керамики. Борат Zn[B2O3(OH)5] x H2O при нагр. обезвоживается до Zn2B6O11, который разлагается при 610 °C; получают взаимод. H3BO3 с гидроксидом или гидроксокарбонатом Ц.; борат и его гидраты — антипирены для тканей и бумаги, пигменты в лакокрасочных покрытиях, компоненты люминофоров, флюсов для пайки и сварки металлов.
Карбонат ZnCO3 разлагается выше ~ 150 °C; практически не раств. в воде (5,7∙10−5 по массе) и в органических растворителях, при кипячении с водой переходит в гидроксокарбонат; легко раств. в кислотах, растворах щелочей и солей аммония; получают действием на раствор ZnSO4 раствором КНCO3, насыщенным CO2, с длительной выдержкой на холоде; в природе — минерал смитсонит. Гидроксокарбонат имеет переменный состав, выделены Zn2(OH)2CO3 х 2H2O, Zn4(OH)6CO3 хnH2O, Zn5(OH)6(CO3)2 (минерал гидроцинкит) и др.; растворимость в воде ~ 1∙10−3 % по массе; при 140 °C разлагается; получают действием Na2CO3 на раствор ZnSO4 при кипячении. Карбонаты используют для получения др. соединений Ц.
Ортосиликат Zn2SiO4 не раств. в воде и органических растворителях, раств. в 20%-ной HF, разлагается соляной кислотой; получают взаимод. S1C14 или SiF4 с ZnO, обжигом смеси SiO2, ZnCl2 и NaCl в присутствии паров воды, гидротермальным синтезом из ZnO и SiO2 в содовых растворах; в природе — минерал виллемит; люминофор.
Ортофосфат Zn3(PO4)2 из водных растворов кристаллизуется в виде тетрагидрата; не раств. в воде и органических растворителях, раств. в разб. кислотах, растворах щелочей и NH3; при 110 °C теряет 2 молекулы воды, при 210 °C полностью обезвоживается; получают взаимод. растворов ZnSO4 и Na2HPO4 или растворением ZnO в H3PO4, безводный — взаимод. ZnO с (NH4)2HPO4; тетрагидрат — в природе минерал гопеит; компонент композиционных и смазочных материалов, катализаторов орг. синтеза, антикоррозионных пигментов, люминофоров, цинковых удобрений. Ортоарсенат Zn3(AsO4)2 x 4H2O при 150 °C переходит в моногидрат, при 290 o С обезвоживается; известен также октагидрат — в природе минерал кёттигит; не раств. в воде и органических растворителях, раств. в кислотах, растворах щелочей и NH3; получают взаимод. растворов ZnSO4 и Na2HAsO4; антисептик для древесины, инсектицид, компонент необрастающих красок. Стеарат (C17H35COO)2Zn, т. пл. 130 °C; не раств. в воде, этаноле, диэтиловом эфире; вспомогат. сиккатив, загуститель смазок, компонент косметич. кремов, пудры и др.
• см. также цинка ацетат, цинка сульфат, цинка хлорид, цинкорганические соединения
Получение. Исходное сырье в производстве Ц. — сульфидные цинковые и полиметаллич. руды. Используют как гидрометаллургич., так и пирометаллургич. методы получения Ц. Гидрометаллургически получают 85% всего Ц. Цинковые концентраты после флотационного обогащения для удаления S обжигают в печах кипящего слоя или во взвешенном состоянии. Огарок выщелачивают содержащим H2SO4 отработанным электролитом (см. ниже). Полученный раствор ZnSO4 тщательно очищают от Fe обработкой ZnO или избытком исходного огарка (стадия "нейтрального выщелачивания"). Вместе с Fe соосаждаются As, Sb, Al, In, Ga и др. Примеси Cu и Cd, а также Ni удаляют действием цинковой пыли с получением т. наз. медно-кадмиевого кека. Примесь Со удаляют осаждением α-нитрозо-β-нафтолом либо этилксантогенатом Na или К. Для удаления хлора используют либо Ag2SO4, либо CuSO4 и цинковую пыль.
Из очищенного раствора Ц. осаждают электролитически на алюминиевых катодах. Отработанный электролит возвращают на выщелачивание. Остатки от выщелачивания ("цинковые кеки") обычно содержат значит. количества Ц. в виде малорастворимых соед., напр. феррита, а также Pb и др. металлы. Эти кеки либо дополнительно выщелачивают более крепкой H2SO4, либо подвергают вельцеванию — обжигу вместе с коксиком в барабанных вращающихся печах при ~ 1200 °C, в результате чего образуются возгоны оксидов Zn и Pb -"вельц-оксиды". Эти возгоны перерабатывают гидрометаллургически, подобно вышеописанному, в отдельной технол. ветви с попутным выделением концентрата In и др. редких элементов.
Пирометаллургич. производство Ц. также начинают окислит. обжигом, но с получением кускового материала — либо обжигом на ленточной агломерационной машине, либо спеканием порошкообразного огарка. Агломерат в смеси с углем или коксом восстанавливают при температуре выше температуры кипения Ц. Для этой цели используют либо ретортные печи (при этом Ц. отгоняется, но шихта полностью не расплавляется), либо шахтные или электрич. рудно-термич. печи, в которых шихта полностью расплавляется. Во всех случаях пары металлич. Ц. конденсируются. Наиб. летучая фракция, обогащенная Cd, — т. наз. пуссьера — собирается отдельно и перерабатывается для извлечения Cd. Твердые остатки в ретортных печах — "раймовки" — перерабатываются дальше путем, напр., вельцевания.
Для очистки Ц. применяют ликвацию (отделение Pb и Fe), двухступенчатую ректификацию (отделение Pb и Cd, а также Cu, Fe и пр.) и хим. методы, в частности удаление Pb действием металлич. Na и удаление Fe действием А1 под слоем флюса. Ц., полученный гидрометаллургич. путем, переплавляют с добавлением флюса NH4Cl, что способствует удалению Т1 и др.
Для получения Ц. высокой чистоты используют дистилляцию в инертной атмосфере или в вакууме, ректификацию и зонную перекристаллизацию в атмосфере Ar. Предложены методы электролитич. рафинирования, в частности с амальгамными электродами.
Определение. При систематич. анализе Ц. попадает в группу сульфида аммония. Качественно Ц. обнаруживают по реакции с (NH4)2[Hg(SCN)4] — в присутствии ионов Cu образуется фиолетовый, в присутствии ионов Со — синий осадок. Применяют также реакцию с дитизоном (красное окрашивание), метиловым фиолетовым (синее окрашивание или фиолетовый осадок в присутствии NH4SCN) и др. Удобно спектральное определение Ц. по группе из трех линий 334,502, 334,557 и 334,593 нм или по двум линиям 330,259 и 330,294 нм. Количественно Ц. определяют гравиметрически осаждением в виде NH4ZnPO4 с послед. прокаливанием до Zn2P2O7, осаждением Zn[Hg(SCN)4] или гидрооксихинолината Ц. Но чаще используют титриметрич. методы — титрование комплексоном III в кислой или щелочной среде с индикаторами эриохром черный Т (pH 10), мурексид, ксиленоловый оранжевый, дитизон (pH 4—5) и т. д. Для определения малых количеств Ц. применяют фотометрич. метод, в частности с использованием дитизона. Применяют полярографич. метод, амперометрич. и потенциометрич. титрование (напр., ферроцианидом К), эмиссионный спектральный, атомно-абсороционный и др.
Применение. Осн. область использования — антикоррозионные покрытия (цинкование) железа и стали. Листы металлич. Ц. применяют в аккумуляторах и сухих элементах, в типографском деле. Ц. используют в металлургии при рафинировании Pb от Ag и Au; цинковую пыль — для выделения Cd, In, Au и т. п. из растворов цементацией. Ц. в соляной кислоте и цинковая пыль — восстановители в орг. синтезе. Широко применяют цинка сплавы, расходуется Ц. также на производство разл. соед., в частности пигментов (цинковые белила). Примерное распределение Ц. по областям использования (в %) — цинкование и покрытия сплавами Ц. — 45; хим. источники тока — 20; латуни и бронзы — 15; сплавы на основе Ц. — 12; пигменты и пр. — 8.
Объем мирового производства Ц. (без СССР) 5,22 млн. т (1989). Осн. производители — Канада, Япония, США, Германия, Бельгия, Франция, Австралия.
Ц. в небольших количествах необходим для жизнедеятельности растений (см. цинковые удобрения), животных и человека, т. к. входит в состав некоторых ферментов и гормонов. Потребность человека в Ц. 15 мг в сут.
Металлич. Ц. малотоксичен, но хранить продукты в цинковой посуде не рекомендуется. Некоторые соед., в частности оксид, фосфид, токсичны. Пары ZnO, а также цинковая пыль вызывают т. наз. литейную лихорадку (симптомы — озноб, ломота и боль в мышцах, головная боль, тошнота и кашель). Растворимые соли Ц. вызывают расстройство пищеварения, раздражение слизистых оболочек. В воздухе рабочей зоны ПДК ZnO 0,5 мг/м3, временно допустимая доза ZnCO3 и ZnSe 2,0 мг/м3, фосфатов и нитрата 0,5 мг/м3, ПДК в воде для Ц. 1,0 мг/л, в водоемах для разведения рыб 0,01 мг/л, в почве 23,0 мг/кг. ПДК Ц. в продуктах питания, мг/кг: рыбных , мясных 20,0, молочных 5,0, хлебе, зерне 25,0, овощах, фруктах, соках 10,0. Цинковая пыль пирофорна.
Сплавы Ц. (латунь) были известны с глубокой древнос (2400–2000 до н.э.). Получение Ц. описал Страбон (1 в. д. н. э.). Пром. производство Ц. в Европе началось в 1743, в Китае на 400 лет раньше.
Лит.: Лакерник М.М., Пахомов а Г. Н., Металлургия ЦИНКА и кад мия, М., 1969; Живописцев В.П., Селезнева Е. А., Аналитическая химия цинка, М., 1975; Зайцев В.Я., Маргулис Е. В., Металлургия свин ца и цинка, М., 1985; Ауlett В. J., в кн.: Comprehensive inorganic chemistry, v. 3, Oxf. — [a.o.l, 1973, p. 187–253.
П. И. Федоров
Значения в других словарях
- Цинк — I (лат. Zincum) Zn, химический элемент II группы периодической системы Менделеева; атомный номер 30, атомная масса 65,38, синевато-белый металл. Известно 5 стабильных изотопов с массовыми числами 64, 66, 67, 68 и 70; наиболее распространён 64Zn (48,89%). Большая советская энциклопедия
- цинк — -а, м. Химический элемент, ковкий металл синевато-белого цвета. [нем. Zink] Малый академический словарь
- Цинк — (нем. Zink; итал. cornetto — рожок) — старинный дух. мундштучный муз. инструмент. Имел конич. прямой или изогнутый ствол с 7 игровыми отверстиями (6 на лицевой стороне, 1 на тыльной). Музыкальная энциклопедия
- цинк — Zn, металл голубовато-белого цвета; химический элемент 11-й группы периодической системы, ат. н. 30, ат. масса 65.39. В природе широко распространён в виде минерала сфалерита (цинковая обманка). Известен с начала н. Техника. Современная энциклопедия
- цинк — орф. цинк, -а Орфографический словарь Лопатина
- цинк — Цинк/. Морфемно-орфографический словарь
- цинк — ЦИНК а, м. zinc m. <, нем. Zink. Химический элемент, ковкий металл синевато-белого цвета. Листовой цинк. БАС-1. Металл белый, листоватый, которой с первого вида удобно можно смешать с висмутом либо сурьмою, но познается по синеватому отливу... Словарь галлицизмов русского языка
- цинк — Пароль, условный знак Словарь воровского жаргона
- цинк — ЦИНК (Zincum) , Zn, хим. элемент II гр. периодич, системы Менделеева. Металл. Содержание Ц. в земной коре 8,3-10-3% (по массе). Образует 66 минералов — цинкит, сфалерит и др. Входит в состав полиметаллич. руд. Содержание Ц. в почве ок. 50 мг/кг. Сельскохозяйственный словарь
- цинк — Заимств. в XVIII в. из нем. яз. (Zink «цинк».). Этимологический словарь Шанского
- ЦИНК — ЦИНК (символ Zn), синевато-белый металлический элемент группы II периодической таблицы, известный с древних времен. Основные источники — минералы сфалерит (цинковая обманка), смитсонит и каламин. Научно-технический словарь
- Цинк — (Zincum; Zn) химический элемент II группы периодической сие темы Д.И. Менделеева; атомный номер 30, атомная масса 65,38; микроэлемент организма человека, входящий в состав инсулина, ряда ферментов и участвующий в процессах кроветворения. Медицинская энциклопедия
- Цинк — Zn (Zincum * a. zink; н. Zink; ф. zinc; и. cine, zinc), — хим. элемент II группы периодич. системы Mенделеева, ат. н. 30, ат. м. 65,39. Горная энциклопедия
- цинк — ЦИНК, а, м. Химический элемент, ковкий металл синевато-белого цвета. | прил. цинковый, ая, ое. Толковый словарь Ожегова
- цинк — ЦИНК -а; м. 1. Химический элемент (Zn), ковкий металл синевато-белого цвета (широко используется в промышленности, входит составной частью во многие сплавы). 2. Воен. Коробка, ящик, сделанный из этого металла. Три цинка патронов. ◁ Цинковый, -ая, -ое. Ц. порошок. Ц-ая руда. Ц-ое ведро. Ц-ая мазь. Толковый словарь Кузнецова
- цинк — Название этого металла заимствовано из немецкого, где находим ZInk с тем же значением. Этимологический словарь Крылова
- цинк — ЦИНК м. металл шпиаутер, свинцового цвета, но жесткий и хрупкий. Цинковое ведро. Цинковая руда, она бывает: — обманка, — купорос, — шпат и пр. Цинковать железо, лудить его цинком. Цинкованье, действие по глаголу. Цинковальня, мастерская, где это делается. Толковый словарь Даля
- Цинк — I (фр., англ. Zinc, нем. Zink; хим. знак Zn, ат. вес 65,4). — Хотя сплавы Ц. (напр., с медью — латунь, см.) известны были человечеству с глубокой древности, но получение самого Ц. в отдельности относится к сравнительно недавнему времени — XV или XVI... Энциклопедический словарь Брокгауза и Ефрона
- цинк — Цинка, мн. нет, м. [нем. Zink] (хим.). Химический элемент, металл синевато-белого цвета, ковкий и тягучий. Большой словарь иностранных слов
- ЦИНК — ЦИНК (в музыке) — см. Корнет. ЦИНК (лат. Zincum) — Zn, химический элемент II группы периодической системы Менделеева, атомный номер 30, атомная масса 65,39. Серебристо-белый металл; плотность 7,133 г/см3, tпл 419,5 °С. Большой энциклопедический словарь
- цинк — цинк м. 1. Химический элемент, ковкий металл синевато-белого цвета, широко используемый в промышленности. 2. Коробка, ящик, сделанные из такого металла. Толковый словарь Ефремовой
- цинк — Из нем. Zink – то же, стар. (der) Zinken (в конце ХV в.; см. Клюге-Гётце 712). Исконно слав. образование в высшей степени сомнительно, вопреки Фальку – Торпу (969), Преобр. (Труды I, стр. 47). Этимологический словарь Макса Фасмера
- цинк — ЦИНК, цинка, мн. нет, ·муж. (·нем. Zink) (·хим. ). Химический элемент, металл синевато-белого цвета, ковкий и тягучий. Листовой цинк. Толковый словарь Ушакова
