хрома галогениды
ХРОМА ГАЛОГЕНИДЫ
Дифторид CrF2 при давлении 2,7 ГПа превращается в ромбич. модификацию, при 27–29 ГПа — в тетрагональную (табл.); плохо раств. в воде, не раств. в этаноле, медленно реагирует с минеральными кислотами; на воздухе окисляется; с фторидами щелочных металлов образует комплексы MCrF3 и M2CrF4. Трифторид CrF3 не раств. в воде, этаноле, растворах NH3, плохо раств. в кислотах, при нагр. на воздухе превращается в Cr2O2, водяным паром гидролизуется выше ~ 500 °C; с фторидами щелочных металлов при сплавлении образует M3CrF6 и M5Cr3F14 зеленого цвета; ферримагнетик. Ниже 15 °C устойчив нонагидрат CrF3 х 9H2O (фиолетовый), растворимость в воде 0,9% при 0 °C, легко обезвоживается до гексагидрата (фиолетовый, плохо раств. в воде). Выше 20 °C из водных растворов кристаллизуется зеленый тригидрат CrF3 х 3H2O, его растворимость в воде 3,46% по массе при 20 °C, растворы склонны к пересышению. Не растворимый в воле тригидрад, для которого предложена формула [Cr(H2O)6]CrF6, образуется при нагр. гексагидрата при 60–70 °C. Получают CrF3 взаимод. гидроксида или солей Cr(III) с плавиковой кислотой, восстановлением CrO3 в растворе HF, напр., этанолом; протрава при крашении тканей, пигмент.
Тетрафторид CrF4 — коричневое аморфное вещество; т. пл. 277 °C, т. возг. 295 °C; плотн. 2,90 г/см3; 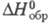 −1200 кДж/моль; при действии воды диссоциирует на соед. Cr(III) и Cr(IV), разъедает стекло, образует с щелочными металлами соед. типа M2CrF6; образуется при фторировании порошка Cr. При фторировании под давлением получают пентафторид CrF5 и лимонно-желтый гексафторид CrF6, который легко диспропорционирует в вакууме уже при 100 °C. Диоксидифторид хрома (хромилфторид) CrO2F2 на свету медленно полимеризуется, превращаясь в серое вещество с т. пл. ~ 200 °C; водой легко гидролизуется; разрушает стекло, кварц, бурно окисляет орг. вещества; с хроматами образует фторохроматы, напр. KCrO3F; получают при натр. K2Cr2O7 с дымящей H2SO4 и CaF2; реагент в орг. и неорг. синтезе.
−1200 кДж/моль; при действии воды диссоциирует на соед. Cr(III) и Cr(IV), разъедает стекло, образует с щелочными металлами соед. типа M2CrF6; образуется при фторировании порошка Cr. При фторировании под давлением получают пентафторид CrF5 и лимонно-желтый гексафторид CrF6, который легко диспропорционирует в вакууме уже при 100 °C. Диоксидифторид хрома (хромилфторид) CrO2F2 на свету медленно полимеризуется, превращаясь в серое вещество с т. пл. ~ 200 °C; водой легко гидролизуется; разрушает стекло, кварц, бурно окисляет орг. вещества; с хроматами образует фторохроматы, напр. KCrO3F; получают при натр. K2Cr2O7 с дымящей H2SO4 и CaF2; реагент в орг. и неорг. синтезе.
Дихлорид CrCl2 относительно устойчив в сухом воздухе, с O2 начинает реагировать при ~ 900 °C, быстро увлажняется и окисляется в присуг. паров воды; из водных растворов (голубых) кристаллизуются кристаллогидраты: до 38 °C — темно-синий тетрагидрат, в интервале 38–51 °C — его темно-зеленая модификация, при 51–83 °C — бледно-голубой тригидрат, выше 83 °C — бледно-зеленый дигидрат, который обезвоживается при 113 °C. CrCl2 мало раств. в этаноле, не раств. в эфире, с хлоридами щелочных металлов образует соед. типов М3CrCl5, МCrCl3, М2CrCl4; получают действием HCl на Cr или H2 на CrCl3 при 600–700 °C; используют для получения Cr высокой чистоты, как реагент в аналит. химии.
СВОЙСТВА ГАЛОГЕНИДОВ И ОКСОГАЛОГЕНИДОВ ХРОМА
таблица в процессе добавления
* Т. возг. ** 
Трихлорид CrCl3 известен также в тригон. модификации; антиферромагнетик; начинает реагировать с O2 при 350 °C, с H2 — при 515 °C, восстанавливаясь до CrCl2, а выше 700 °C — до Cr; не раств. в воде, в присутствии восстановителей (CrCl2) раств. хорошо, давая темно-зеленые растворы. Из водных растворов ниже 30 °C кристаллизуется декагидрат (темно-зеленый), выше 30 °C — гексагидрат, для которого известны 4 изомерные формы. При обезвоживании гексагидрата получают коричневый тригидрат, фиолетовый дигидрат и красные CrCl3 x 1,5H2O и CrCl3 x 0,5H2O. Полное обезвоживание сопровождается гидролизом. При сплавлении с хлоридами щелочных металлов CrCl3 образует хлорохроматы преим. типов М3CrCl6 и М3Cr2Cl9.
Получают CrCl3 хлорированием Cr2O3, хромита или феррохрома в присутствии восстановителей при 600–800 °C. Используют для хромирования стальных изделий, для получения Cr. Кристаллогидрат получают растворением Cr(OH)3 в соляной кислоте или восстановлением растворов CrO3 в соляной кислоте формалином; применяют как протраву при крашении, компонент электролитов, для получения др. соед. Cr.
Тетрахлорид CrCl4 устойчив только в парах, м. б. сконденсирован при резком охлаждении, но разлагается уже при −80 °C.
Из оксохлоридов Cr наиб. важен хромилхлорид CrO2Cl2 — вишнево-красная жидкость; т. пл. −96 °C; т. кип. 116 С; 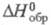 −570,3 кДж/моль; дымит на воздухе, под действием света разлагается с выделением Cl2; сильный окислитель и хлорирующий агент; со мн. орг. веществами реагирует со взрывом; бурно разлагается водой с образованием H2CrO4 и HCl; раств. в CCl4, CHCl3, CS2, бензоле, хорошо растворяет Cl2; горит в сухом NH3; получают взаимод. CrO3 с конц. соляной кислотой и H2SO4 или действием H2SO4 на смесь K2Cr2O7 + NaCl; реагент в орг. синтезе, при получении комплексов Cr.
−570,3 кДж/моль; дымит на воздухе, под действием света разлагается с выделением Cl2; сильный окислитель и хлорирующий агент; со мн. орг. веществами реагирует со взрывом; бурно разлагается водой с образованием H2CrO4 и HCl; раств. в CCl4, CHCl3, CS2, бензоле, хорошо растворяет Cl2; горит в сухом NH3; получают взаимод. CrO3 с конц. соляной кислотой и H2SO4 или действием H2SO4 на смесь K2Cr2O7 + NaCl; реагент в орг. синтезе, при получении комплексов Cr.
Дибромид CrBr2 быстро окисляется на воздухе, в отсутствие O2 дает голубые водные растворы, образует гексагидрат; получают восстановлением CrBr3 водородом и др. Трибромид CrBr3 при нагр. окисляется, медленно раств. в горячей воде, быстро — в присутствии восстановителей; известно неск. форм гексагидрата; получают взаимод. паров Br2 с порошком Cr.
Дниодид CrI2 хорошо раств. в воде в отсутствие O2 (голубые растворы), образует гексагидрат; получают взаимод. Cr с I2; пигмент для стекла. Трииодид CrI3 при натр, отщепляет I2, с трудом раств. в воде, легко — в присутствии CrI2, из растворов кристаллизуется темно-фиолетовый гексагидрат; получают из простых веществ. Иодиды Cr — промежут. продукты при иодидном рафинировании Cr.
П. И. Федоров
