хроматы
ХРОМАТЫ
соли хромовых кислот (см. хрома оксиды). Наиб. часто встречаются хроматы(VI) — производные CrO3, желтого или красного цвета (табл. 1). Их получают взаимод. растворов H2CrO4 (или CrO3) с оксидами, гидроксидами, карбонатами металлов, осаждением из растворов солей при действии Х. натрия или К, а также окислением соед., содержащих Cr в низших степенях окисления. Известно неск. относящихся к Х. минералов, напр. крокоит PbCrO4. X.(VI) большей частью изоморфны с соответствующими сульфатами. Анион CrO42− имеет тетраэдрич. строение.
Х. щелочных металлов и Mg хорошо раств. в воде, у Х. щел.-зем. металлов растворимость сильно уменьшается от Ca к Ва. Растворы Х. имеют щелочную реакцию, Х. тяжелых металлов в воде большей частью практически не раств., в особенности соли Pb, Bi, Ag, Hg. X. РЗЭ плохо раств., причем соед. элементов иттриевой группы водой разлагаются с образованием основных солей. Х. щелочных и щел.-зем. металлов плавятся без разложения, Х. остальных металлов большей частью разлагаются до плавления.
При подкислении растворов Х. образуются дихроматы (бихроматы), что сопровождается переходом их окраски в оранжевую. Дихромат-анион Cr2O72−построен из двух хромкислородных тетраэдров с общей вершиной по атому кислорода. Дихроматы щелочных, щел.-зем. и большинства тяжелых металлов легко раств. в воде. Трудно растворимы дихроматы Ag, Т1. Растворы дихроматов имеют кислую реакцию. Дихроматы менее термически устойчивы по сравнению с X.(VI). Дихроматы — реагенты в дихроматометрии.
Для щелочных (кроме Li) и некоторых др. металлов известны темно-красные трихроматы М2Cr3O10 и коричнево-красные тетрахроматы М2Cr4O13. Для мн. металлов получены оксохроматы и гидроксохроматы (основные X.). Оксо- и гидроксохроматы тяжелых металлов в воде не раств. Описано большое число двойных хроматов, напр. KZn2(CrO4)2OH х H2O (используются как пигменты), хромато-сульфатов и т. д. Для некоторых металлов известны хромато-дихроматы, напр. Bi2(CrO4)2Cr2O7.
• см. также калия дихромат, натрия хромат
При действии H2O2 на водные растворы Х. в зависимости от условий можно получить пероксохроматы: синие — состава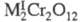 (получают из кислых растворов) либо красные — состава
(получают из кислых растворов) либо красные — состава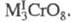 Синие пероксохроматы очень неустойчивы; при ударе, нагревании или соприкосновении с конц. H2SO4 они взрываются. Красные пероксохроматы разлагаются при нагр., при обычных температурах довольно устойчивы.
Синие пероксохроматы очень неустойчивы; при ударе, нагревании или соприкосновении с конц. H2SO4 они взрываются. Красные пероксохроматы разлагаются при нагр., при обычных температурах довольно устойчивы.
X.(VI) калия K2CrO4 — лимонно-желтые кристаллы; при 668 °C ромбич. форма переходит в гексагон. красную, 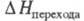 10,0 кДж/моль; т. пл. 973 °C,
10,0 кДж/моль; т. пл. 973 °C, 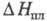 33,0 кДж/моль; растворимость в воде 38,96% по массе при 20 °C; не раств. в этаноле, эфире; получают взаимод. K2Cr2O7 и K2CO3 в водном растворе; в природе минерал тарапакоит; протрава при крашении, дубитель в кожевенной промышленности, отбеливатель для масел, воска, протрава для семян, окислитель в орг. синтезе, реагент в хроматометрии.
33,0 кДж/моль; растворимость в воде 38,96% по массе при 20 °C; не раств. в этаноле, эфире; получают взаимод. K2Cr2O7 и K2CO3 в водном растворе; в природе минерал тарапакоит; протрава при крашении, дубитель в кожевенной промышленности, отбеливатель для масел, воска, протрава для семян, окислитель в орг. синтезе, реагент в хроматометрии.
X.(VI) аммония (NH4)2CrO4 — золотисто-желтые кристаллы, растворимость в воде 27,2% по массе при 25 °C, мало раств. в этаноле и в ацетоне; т. разл. 180 °C; при хранении на воздухе постепенно теряет NH3 и превращается в дихромат; получают взаимод. растворов NH3 с CrO3 или (NH4)2Cr2O7; протрава при крашении тканей, дубящее вещество, компонент светочувствит. слоя фотоматериалов. Дихромат аммония (NH4)2Cr2O7 — оранжево-красные кристаллы; разлагается выше 170 °C, при 240 °C — со вспышкой; растворимость в воде 29,18% по массе при 25 °C, раств. в этаноле, не раств. в ацетоне; получают взаимод. NH4C1 с Na2Cr2O7 в водном растворе; окислитель в орг. синтезе, отбеливатель для жиров, воска, парафина, компонент светочувствит. слоя фотоматериалов, исходное вещество для синтеза оксидов Cr, катализаторов, получения фоторезисторов, фотосенсибилизаторов, компонент пиротехн. составов, консервант для древесины.
X.(VI) кальция CaCrO4 — желтые кристаллы; при 50 °C становится красно-коричневым (при охлаждении окраска восстанавливается); т. пл. ~ 1150 °C (под давлением O2), при атм. давлении т. пл. 1022 °C (с разл.); растворимость в воде 2,27% при 19 °C, 0,79% при 70 °C; из растворов кристаллизуются ди-, моно- и гемигидраты, обладающие существенно большей растворимостью и полностью обезвоживающиеся при ~ 400 °C; раств. в этаноле; получают взаимод. растворов Na2Cr2O7 с Ca(OH)2, либо Na2CrO4 с CaCl2 с послед. прокаливанием осадка; в природе минерал хроматит; компонент шихты при алюмотермич. получении Cr, пигмент, ингибитор коррозии, компонент покрытий для легких сплавов, деполяризатор для батарей, окислитель при получении Cr.
X.(VI) бария BaCrO4 — желтые кристаллы; т. пл. 1380 °C; практически не раств. в воде и органических растворителях, разлагается кислотами; получают взаимод. BaCl2 с K2Cr2O7; окислитель при синтезе красителей, компонент ВВ, пиротехн. составов, антикоррозионных покрытий на стали, составов головок спичек, пигмент (баритовый желтый) для керамики. X.(VI) цинка ZnCrO4 — лимонно-желтые кристаллы; разлагается выше 440 °C; практически не раств. в воде; образует гидраты с 7, 2 и 1 молекулами воды; при кипячении с большим количеством воды гидролизуется с образованием гидроксохроматов; получают взаимод. Zn(OH)2 с K2Cr2O7; пигмент, компонент антикоррозионных покрытий.
X.(VI) свинца PbCrO4 — желтые или оранжево-красные кристаллы; при 707 °C превращается в желтую ромбическую, а при 783 °C — в красную тетрагон. модификации; т. пл. 844 °C (с разл.); практически не раств. в воде и органических растворителях; раств. в HNO3, конц. растворах щелочей; получают взаимод. растворов нитрата или ацетата Pb с хроматами Na, К или NH+4; пигмент (желтый крон), окислитель в орг. синтезе, компонент материалов термохромных датчиков. Оксохромат свинца
Табл. 1 — СВОЙСТВА НЕКОТОРЫХ XPOMATOB(VI)
таблица в процессе добавления
Табл. 2 — СВОЙСТВА НЕКОТОРЫХ ХРОМАТОВ(III)
таблица в процессе добавления
Pb2CrO5 — оранжевые или красные кристаллы, пигмент (оранжевый крон), материал для термисторов.
Хроматы(V) (иногда их наз. хроманатами) — большей частью черного, голубовато-черного или темно-зеленого цвета, содержат тетраэдрич. анион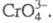 Для щелочных металлов получены соед. типа М3CrO4 и МCr3O8, для щел.-зем.-типа М3(CrO4)2, М2Cr2O7 и М5(CrO4)3OH, для РЗЭ — типа МCrO4. Получают X.(V) термич. разложением X.(VI) в смеси с оксидом или нитратом соответствующего металла, гидротермальным путем, взаимод. оксидов при высоких давлениях и т. д. Мало раств. в воде, при кипячении с водой гидролизуются с диспропорционированием на Cr(III) и Cr(VI).
Для щелочных металлов получены соед. типа М3CrO4 и МCr3O8, для щел.-зем.-типа М3(CrO4)2, М2Cr2O7 и М5(CrO4)3OH, для РЗЭ — типа МCrO4. Получают X.(V) термич. разложением X.(VI) в смеси с оксидом или нитратом соответствующего металла, гидротермальным путем, взаимод. оксидов при высоких давлениях и т. д. Мало раств. в воде, при кипячении с водой гидролизуются с диспропорционированием на Cr(III) и Cr(VI).
Хроматы(IV) большей частью представляют собой сложные оксиды, хотя в структуре некоторых из них имеется тетраэдрич. анион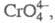 преим. зеленого цвета. Для щелочных металлов известны Х. типа М2CrO3 и М4CrO4, для щел.-зем. — типа МCrO3, М2CrO4, М3CrO5 и М4СeO6.
преим. зеленого цвета. Для щелочных металлов известны Х. типа М2CrO3 и М4CrO4, для щел.-зем. — типа МCrO3, М2CrO4, М3CrO5 и М4СeO6.
Хроматы(III) (устар. назв. хромиты) представляют собой сложные оксиды (табл. 2). Х.(III) металлов в степени окисления + 1имеют состав МCrO2 (метахромиты), получены также М3CrO3 (ортохромиты). Для металлов в степени окисления +2 характерны соед. МCr2O4 (многие из них имеют структуры типа шпинели). РЗЭ, кроме Sc, дают соед. МCrO3 со структурами типа перовскита. Получают Х.(III) спеканием Cr2O3 с оксидами, карбонатами и др. соед. металлов, а также восстановлением или термич. разложением X.(VI) и дихро-матов(VI). Из растворов, получающихся в результате растворения гидроксида Cr(III) в щелочи, кристаллизуются гидроксохроматы(III) состава МCr(OH)4, М3Cr(OH)6 и даже М4Cr(OH)7. Для щел.-зем. металлов получены гидроксохроматы типа М3Cr2(OH)2 со структурой типа граната. Х.(III) в осн. тугоплавки, химически стойки.
Х.(III) магния MgCr2O4 — темно-зеленые, серо-зеленые или красные кристаллы; получают нагреванием MgCr2O7 или спеканием MgO с Cr2O3 с добавкой В2O3; в природе минерал магнезиохромит; компонент огнеупоров, катализатор орг. синтеза. Х.(III) цинка ZnCr2O4 — светло-зеленые кристаллы; получают прокаливанием смеси нитратов Zn и Cr или термич. разложением ZnCr2O7; катализатор орг. синтеза, компонент керамич. датчиков влажности. Х.(III) желез а(II) FeCr2O4 — черные или темно-коричневые кристаллы; получают нагреванием смеси FeCl3 + K2Cr2O7 или Fe2O3 + Cr2O3 с добавкой H3BO3; в природе минерал хромит; компонент огнеупоров, катализатор орг. синтеза; природный — сырье для извлечения Cr.
• см. также лантана хромат
Известны X., содержащие Cr в двух степенях окисления, в частности +3 и +4 (напр., Sr4Cr2O9), +4 и +6 [Ca5(CrO4)3] или +5 и +6 [Ca10(CrO4)7]. Иногда их наз. хромито-хроматами, а состав выражают формулой mMO x nCrO3 xpCr2O3.
Х. и дихроматы Na, К и аммония обладают местным и общим токсич. действием. Их аэрозоли вызывают прободение хрящевой части носовой перегородки, воспаление гортани и придатков носовой полости. Могут вызвать тяжелые ожоги кожи, экзему, язвы. Поражают органы дыхания и желудочно-кишечный тракт. Токсична пыль и нерастворимых X., некоторые канцерогенны. ПДК Х. (в пересчете на CrO3) 0,01 мг/м3.
П. И. Федоров
Значения в других словарях
- Хроматы — Соли хромовой кислоты и изополихромовых кислот. Ниже рассматриваются соли хромовой (H2CrO4) кислоты — монохроматы, или просто Х. Х. устойчивы только в щелочной среде; при подкислении переходят в Дихроматы. Наиболее важны Х. калия и натрия. Большая советская энциклопедия
- хроматы — -ов, мн. (ед. хромат, -а, м.). Соли хромовой кислоты. Малый академический словарь
- хроматы — орф. хроматы, -ов, ед. -ат, -а Орфографический словарь Лопатина
- хроматы — ХРОМАТЫ -ов; мн. (ед. хромат, -а; м.). Соли хромовой кислоты. Толковый словарь Кузнецова
- ХРОМАТЫ — ХРОМАТЫ — соли хромовой кислоты H2CrO4 — хроматы (VI) — хромистой HCrO2 — хроматы (III) — или хромиты, и дихромовой H2Cr2O7 — дихроматы. Сильные окислители. Большой энциклопедический словарь
