хелаты
ХЕЛАТЫ (клешневидные соединения, хелатные соединения) (от греч. chele — клешня)
координационные соединения, в которых центр, атом (или ион) связан одновременно с двумя или более донорными атомами лиганда, в результате чего замыкается один или неск. гетероциклов. Лиганды, образующие хелатные циклы, наз. хелатирующими (хелатообразующими) реагентами, они должны быть по крайней мере бидентатными. Замыкание хелатного цикла такими лигандами наз. хелатированием или хелатообразованием.
Наиб. обширный и важный класс Х. — хелатные комплексы металлов (металлохелаты). Способность координировать лиганды присуща металлам всех степеней окисления. Элементы осн. подгрупп в качестве центр. атомов-комплексообразователей обычно выступают лишь в высших степенях окисления.
Хелатирующие реагенты содержат два осн. типа электронодонорных центров: А — группы, содержащие подвижный протон, напр. — COOH, — OH, — SO3H, при их координации к центр, иону возможно замещение протона; Б — нейтральные электронодонорные группы, напр. R2CO, R3PO, R3N.
X., в которых при замыкании хелатного цикла лиганд использует протон-содержащую и нейтральную электронодонорные группы и формально связан с центральным атомом ковалентной и донорно-акцепторной связью, наз. внутрикомплексными соединениями (внутренние комплексные соли), напр., ацетилацетонаты формул I и II.
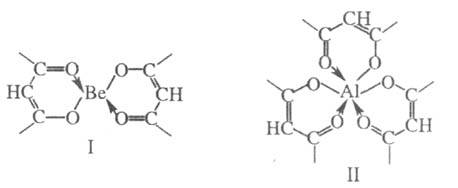
Бидентатные лиганды занимают во внутр. сфере Х. два координац. места, как, напр., в соед. I и II. Примеры др. бидентатных лигандов: этиленгликоль (формула III; два центра типа A)1 диоксид метилендифосфина (IV; два центра типа Б), a-пиколиновая кислота (IV; центры типа А и Б).
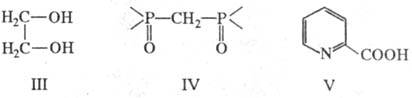
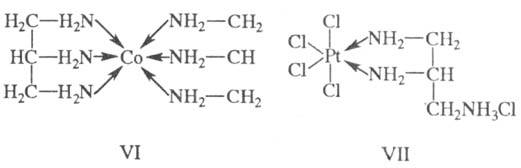
Тридентатный лиганд, напр. триаминопропан, может занимать во внутр. сфере как три (соед. VI), так и два (соед. VII) координационных места или даже координироваться монодентатно.
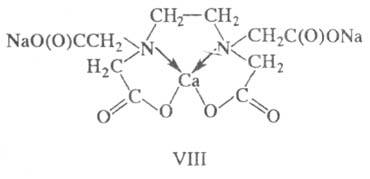
Аналогично тетра-, пента- .и гексадентатные лиганды в зависимости от условий проявляют разную дентатность. Например, гексадентатный лиганд ЭДТА (этилендиаминтетраук-сусная кислота) по отношению к иону Ca2+ является тетрадентатным, при этом м. б. выделена динатриевая соль VIII. К Х. с полидентатными лигандами относятся комплексы краун-эфиров и криптандов.
Стабильность Х. обычно выше по сравнению с аналогами, образованными монодентатными лигандами (т. наз. хелатный эффект). В общем виде константа образования циклич. комплекса MAA (M — металл; AA — бидентатный лиганд) намного больше, чем константа образования MA2' (A' — монодентатный лиганд, близкий по характеру к лиганду AA). Хелатный эффект оценивают по разности между логарифмами констант устойчивости MAA и MA2'.
Наряду с общими факторами, определяющими устойчивость координац. соед., такими, как природа центр. иона и координированных донорных атомов лиганда, в случае Х. важную роль играют число атомов в образующемся цикле и наличие кратных связей в мостике между донорными атомами хелатного лиганда.
Х. чаще всего имеют тетраэдрич. и октаэдрич. конфигурации; в случае отсутствия кратных связей в мостике наиб. устойчивы 5- и 6-членные циклы (правило циклов Чугаева). Диоксид метил ендифосфина образует устойчивый 6-членный цикл формулы IX. С увеличением длины углеводородного мостика при переходе к диоксиду этилендифосфи-на последний выступает в роли мостиковой группы (формула X) и хелатный цикл не образуется. Наличие кратной связи в диоксиде цис-винилендифосфина приводит к устойчивости семичленного цикла XI.
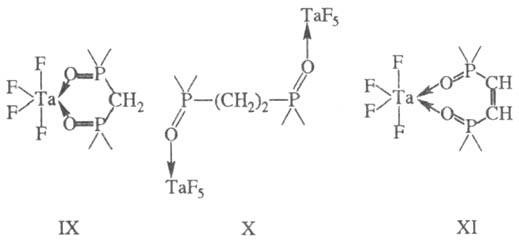
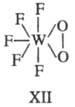
4-членные циклы при тетраэдрич. и октаэдрич. координации центр, иона являются более напряженными и менее прочными. 3-членные хелатные циклы известны для перок-сид-аниона, когда последний занимает два координационных места в экваториальной плоскости пентагональной бипирамиды (формула ХП).
Выделение Х. в самостоятельный тип координац. соед. связано с уникальностью их физ., хим. и биол. свойств, обусловленных наличием хелатного цикла. Ацетилацетонаты вследствие их летучести применяют для разделения и очистки металлов и нанесения металлич. покрытий (см. b-Дикетонаты металлов). Комплексы ЭДТА из-за их высокой растворимости используют для уменьшения жесткости воды, снятия накипи и очистки металлических поверхностей. Яркость цвета, термостойкость, прочность окраски и устойчивость к действию оснований и кислот обусловливают использование фталоцианиновых комплексов в качестве красителей. Цветность ряда Х. и зависимость интенсивности окраски раствора от концентрации иона металла нашли применение в аналит. химии (см. комплексонометрия, комплексоны). Растворимость Х. в органических растворителях используют для экстракционного разделения элементов.
Х. играют важную роль в процессах жизнедеятельности, напр., гемоглобин, хлорофилл и витамин B12 являются хелатными комплексами Fe2+-, Mg2+-, Со2+-оснований порфиринового ряда. X. (напр., соед. VI) используют для вывода ядовитых и радиоактивных металлов из организма и растворения камней (напр., почечных), возникающих при нарушении обмена веществ.
Термин "хелат" ввел M. Дрю в 1920.
Лит.: Гринберг А.А., Введение в химию комплексных соединений, 3 изд., М., 1966; БасолоФ., Джонсон Р., Химия координационных соединений, пер. с англ., М., 1966; Басоло Ф., Пирсон Р., Механизмы неорганических реакций, пер. с англ., М., 1971; Кукушкин Ю.H., Химия координационных соединений, М., 1985.
Е. Г. Ильин
Значения в других словарях
- хелаты — орф. хелаты, -ов Орфографический словарь Лопатина
- хелаты — Хелаты (син.: комплексоны) — соединения органических веществ с металлами, в которых атом металла связан с двумя или с большим числом атомов органического соединения (комплексообразователя). Толковый словарь по почвоведению
- хелаты — ХЕЛАТЫ (от греч. chele — клешня) . внутрикомплексные соединения органич. в-в с металлами, в к-рых атом металла (железа, цинка, меди или др.) связан с 2 или большим числом атомов органич. Сельскохозяйственный словарь
- хелаты — ХЕЛАТЫ — вещества, образующие с металлом комплексную соль, в которой металл закреплен по всем валентностям и пространственно находится внутри молекулы, так что его возможности вступления в реакцию снижаются. X. являются многие биополимеры, сложные органические кислоты, гумусовые вещества. Ботаника. Словарь терминов
