фталевый ангидрид
ФТАЛЕВЫЙ АНГИДРИД (ангидрид 1,2-бензолдикарбоновой кислоты)
мол. м. 148,12; бесцв. орторомбич. кристаллы (параметры решетки а =0,790 нм, b =1,416 нм, с = 0,594 нм); легко возгоняется, т. пл. 130,85 °C, т. кип. 294,5 °C; 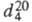 1,527;
1,527; 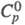 кДж(кг∙К): 1,00 (О °C), 1,07 (20 °C), 1,70 (150 °C); η (Па-с) 1,19 (133 °C), 0,55 (220 °C); γ 0,035 Н/м (155 °C), 0,0327 Н/м (180 °C); давление пара в мм рт. ст.: 0,0018 (35 °C), 0,11 (50 °C), 0,712 (100 °C), 5,88 (130 °C); ΔH0обр −460,02 кДж/моль,
кДж(кг∙К): 1,00 (О °C), 1,07 (20 °C), 1,70 (150 °C); η (Па-с) 1,19 (133 °C), 0,55 (220 °C); γ 0,035 Н/м (155 °C), 0,0327 Н/м (180 °C); давление пара в мм рт. ст.: 0,0018 (35 °C), 0,11 (50 °C), 0,712 (100 °C), 5,88 (130 °C); ΔH0обр −460,02 кДж/моль, 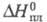 22,93 кДж/моль, ΔH0сгор −3259 кДж/моль;
22,93 кДж/моль, ΔH0сгор −3259 кДж/моль; 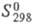 1,79 кДж(моль∙°C). Растворимость (в г на 100 г растворителя): в HCOOH 4,7 (20 °C), CCl4 0,7 (20 °C), CS2 0,7 (20 °C), пиридине 80 (25 °C), воде 0,62 (25 °C), 19,0 (100 °C), 95,0 (135 °C; с образованием фталевой кислоты); плохо раств. в этаноле и диэтиловом эфире.
1,79 кДж(моль∙°C). Растворимость (в г на 100 г растворителя): в HCOOH 4,7 (20 °C), CCl4 0,7 (20 °C), CS2 0,7 (20 °C), пиридине 80 (25 °C), воде 0,62 (25 °C), 19,0 (100 °C), 95,0 (135 °C; с образованием фталевой кислоты); плохо раств. в этаноле и диэтиловом эфире.
Обладает свойствами ароматических соединений. При нагр. с моноатомными спиртами в присутствии H2SO4 (130–140 °C) или орг. солей Ti (200 °C) образует соответствующие сложные моно- и диэфиры, с многоатомными спиртами в присутствии высоких кислот — полиэфиры (см. алкидные смолы). Например, на основе Ф. а. и диолов (этилен-, диэтиленгликоля, пропилен-гликоля) получают полиэфиры; на основе Ф. а. и глицерина — алкидные (глифталевые) смолы.
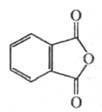
Хлорирование Ф. а. приводит к ангидриду тетрахлорфтале-вой кислоты, из которого получают самозатухающие полиэфирные смолы. С PCl5 образует фталоилдихлорид C6H4(COCl)2. При нитровании Ф. а. дает смесь 3- и 4-нитрофталевых кислот, при сульфировании — смесь 3- и 4-сульфопроизводных. С NH3 и первичными аминами в зависимости от условий реакции Ф. а. образует фталаминовую кислоту (формула I), фталимид (II) или диамид фталевой кислоты (ПI):
При пропускании паров Ф. а. и NH3 при 350–400 °C над оксидами Al, V, W, Cr или Mn получается фталодинитрил.
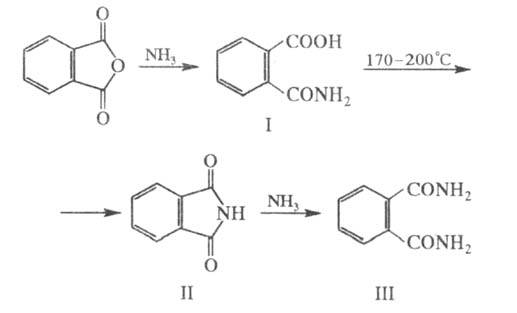
Конденсация Ф. а. с бензолом в присутствии AlCl3 и H2SO4 приводит к антрахинону:
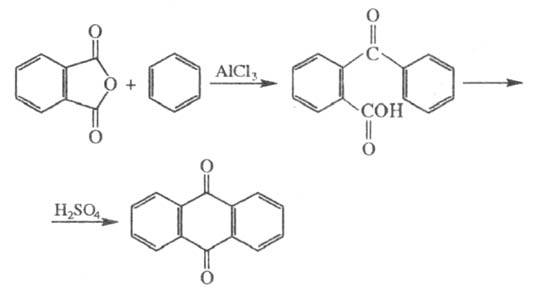
Ф. а. легко реагирует с фенолами и их производными. Так, реакция с фенолом в присутствии H2SO4 и SnCl2 приводит к фенолфталеину, с м-(этиламино)фенолом — к родамину, с резорцином — к флуоресцеину (см. ксантеновые красители), с n-хлорфенолом — к хинизарину. С мочевиной и солями Cu Ф. а. образует нерастворимые пигменты фталоцианины, применяемые в качестве красителей. Декарбоксилирование Ф. а. при 200 °C в присутствии Al2O3, ZnO приводит к бензойной кислоте; это один из пром. способов ее получения.
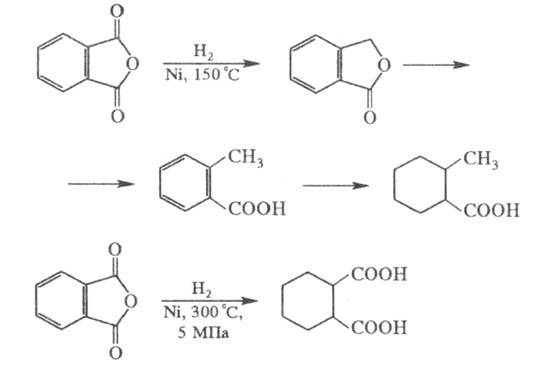
Каталитич. гидрирование Ф. а. на никелевом катализаторе при 150 °C приводит последовательно к фталиду, о-толуило-вой кислоте, гексагидро-о-толуиловой кислоте; гидрирование при 5 МПа и 300 °C над тем же катализатором — к гексагидро-фталевой кислоте:
Ф. а. при взаимодействии с KOH превращается в дикалиевую соль фталевой кислоты, которая при 350–400 °C в присутствии CaCO3 и Zn изомеризуется в терефталевую кислоту.
В промышленности Ф. а. получают парофазным каталитич. окислением кислородом воздуха о-ксилола или нафталина с использованием стационарных или псевдоожиженных (нафталин) катализаторов на основе V2O5 — TiO2 или V2O5 — K2SO4. Процесс проводят при 350–400 °C с избытком O2 воздуха (концентрация углеводорода 40–80 г/м3). Сырой Ф. а. из реакционных газов улавливают в твердом виде в аппаратах калориферного типа, очищают и выделяют ректификацией. Выход при окислении о-ксилола 75–80%, нафталина 85–88%.
Ф. а. применяют в производстве красителей, алкидных смол, пластификаторов, инсектицидов, лекарственных средств, тетрахлорфтале-вого ангидрида. Ф. а. — реагент для обнаружения и титримет-рич. определения низших первичных и вторичных алифатич. спиртов, идентификации фенолов и фенольных смол.
Ф. а. токсичен, вызывает раздражение кожи, слизистых оболочек глаз и носа, способствует заболеванию бронхиальной астмой. ЛД50 4 г/кг (мыши, перорально); ПДК 1 мг/м3, ПДК (в воде) 0,5 мг/л. T. всп. 152 °C, т. воспл. 165 °C, т.са-мовоспл. 580–584 °C; КПВ 10,5% по объему. Объем мирового производства ок. 2,5 млн. т в год (1988).
Лит.: Гуревич Д. А., Фталевый ангидрид, М., 1968; Kirk-Othmer encyclopedia, 3 ed., v. 17, N.Y., 1982, p. 732–46.
А. Ф. Любарский
Значения в других словарях
- Фталевый ангидрид — Ангидридофталевой кислоты, бесцветные кристаллы, практически нерастворимые в воде, умеренно растворимые в органических растворителях, tпл 130,8 °С, tkип 284,5 °С. Ф. а. — важный исходный продукт в производстве различных производных фталевой кислоты (См. Большая советская энциклопедия
- ФТАЛЕВЫЙ АНГИДРИД — ФТАЛЕВЫЙ АНГИДРИД — C6H4(CO)2O, бесцветные кристаллы, tпл 130,8 °С (с возгонкой). Сырье в производстве алкидных смол, пластификаторов (эфиров фталевой кислоты) — красителей. Большой энциклопедический словарь
