ферментативных реакций кинетика
ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ КИНЕТИКА
изучает закономерности протекания во времени ферментативных реакций, а также их механизм; раздел кинетики химической.
Каталитич. цикл конверсии вещества S (субстрата) в продукт P под действием фермента E протекает с образованием промежут. соед. Xi:

где ki — константы скорости отдельных элементарных стадий, KS — константа равновесия образования фермент-субстратного комплекса X1 (ES, комплекс Михаэлиса).
При данной температуре скорость реакции зависит от концентраций фермента, субстрата и состава среды. Различают стационарную, предстационарную и релаксационную кинетику ферментативных реакций.
Стационарная кинетика. В стационарном состоянии по промежуточным соед. (dXi/dt = 0, i = 1, ..., n) и при избытке субстрата  , где [S]0 и [E]0 — начальные концентрации соотв. субстрата и фермента, кинетика процесса характеризуется постоянным, неизменным во времени уровнем концентраций промежут. соед., а выражение для скорости процесса v0, наз. начальной стационарной скоростью, имеет вид (уравнение Михаэлиса — Ментен):
, где [S]0 и [E]0 — начальные концентрации соотв. субстрата и фермента, кинетика процесса характеризуется постоянным, неизменным во времени уровнем концентраций промежут. соед., а выражение для скорости процесса v0, наз. начальной стационарной скоростью, имеет вид (уравнение Михаэлиса — Ментен):
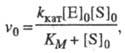 (1)
(1)
где значения kкат и Kм — функции констант скорости элементарных стадий и заданы ур-нениями:
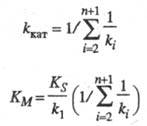
Величину kкат наз. эффективной каталитич. константой скорости процесса, параметр Kм — константой Михаэлиса. Значение kкат определяется величинами ki наиб. медленных стадий каталитич. реакций и иногда наз. числом оборотов фермента (ферментной системы); kкат характеризует число каталитич. циклов, совершаемых ферментной системой в единицу времени. Наиб. распространены ферменты, имеющие значение kкат. для специфич. субстратов в диапазоне 102–103 с−1. Типичные значения константы Михаэлиса лежат в интервале 10−3- 10−4 M.
При больших концентрациях субстрата, когда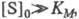
 т. е. скорость реакции не зависит от концентрации субстрата и достигает постоянной величины, наз. макс. скоростью. Графически уравнение Михаэлиса — Ментен представляет собой гиперболу. Его можно линеаризовать, используя метод двойных обратных величин (метод Лайнуи-вера — Берка), т. е. строя зависимость 1/v от 1/[S]0, или др. методы. Линейная форма уравнения (1) имеет вид:
т. е. скорость реакции не зависит от концентрации субстрата и достигает постоянной величины, наз. макс. скоростью. Графически уравнение Михаэлиса — Ментен представляет собой гиперболу. Его можно линеаризовать, используя метод двойных обратных величин (метод Лайнуи-вера — Берка), т. е. строя зависимость 1/v от 1/[S]0, или др. методы. Линейная форма уравнения (1) имеет вид:
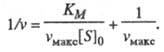 (2)
(2)
Она позволяет определить графически значения Kм и vмакс (рис. 1).
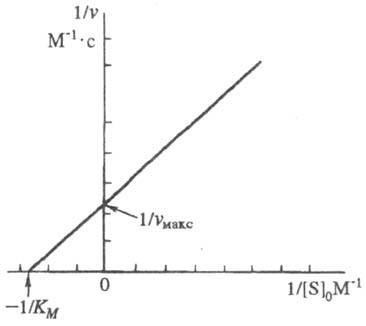
Рис. 1. График линейной трансформации уравнения Михаэлиса — Ментен в двойных обратных величинах (по Лайнуиверу — Берку).
Величина Kм численно равна концентрации субстрата, при которой скорость реакции равна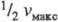 , поэтому Kм часто служит мерой сродства субстрата и фермента, однако это справедливо лишь, если
, поэтому Kм часто служит мерой сродства субстрата и фермента, однако это справедливо лишь, если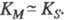
Величины Kм и vm изменяются в зависимости от значений pH. Это связано со способностью участвующих в катализе групп молекулы фермента изменять свое состояние ионизации и, тем самым, свою каталитич. эффективность. В простейшем случае изменение pH приводит к протонированию или депротонированию, по крайней мере, двух ионизирующихся групп фермента, участвующих в катализе. Если при этом только одна форма фермент-субстратного комплекса (напр., ESH) из трех возможных (ES, ESH и ESH2) способна превращаться в продукт реакции, то зависимость скорости от pH описывается формулой:
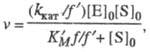
где f = 1 + [H+]/Kа + Kb /[H+] и f ' = 1 + [H+]/К'а + K'b/[H+] — т. наз. pH-функции Михаэлиса, а Kа, Kb и К'a, K'b- константы ионизации групп а и b соотв. своб. фермента и фермент-субстратного комплекса. В координатах lg kкат — pH эта зависимость представлена на рис. 2, причем тангенсы углов наклона касательных к восходящей, независимой от pH, и нисходящей ветвям кривой должны быть равны соответственно +1, 0 и -1. Из такого графика можно определить значения pKа групп, участвующих в катализе.
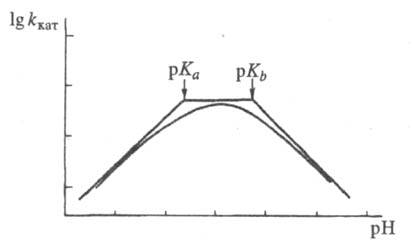
Рис. 2. Зависимость каталитич. константы от pH в логарифмич. координатах.
Скорость ферментативной реакции не всегда подчиняется уравнению (1). Один из часто встречающихся случаев — участие в реакции аллостерич. ферментов (см. регуляторы ферментов), для которых зависимость степени насыщения фермента от [S]0 имеет негиперболич. характер (рис. 3). Это явление обусловлено кооперативностью связывания субстрата, т. е. когда связывание субстрата на одном из участков макромолекулы фермента увеличивает (положит. кооперативность) или уменьшает (отрицат. кооперативность) сродство к субстрату др. участка.
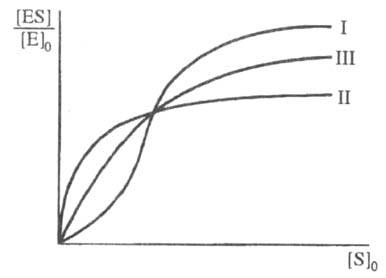
Рис. 3. Зависимость степени насыщения фермента субстратом от концентрации субстрата при положительной (I) и отрицательной (II) кооперативности, а также в ее отсутствии (III).
Предстационарная кинетика. При быстром смешении растворов фермента и субстрата в интервале времен 10−6–10−1 с можно наблюдать переходные процессы, предшествующие образованию устойчивого стационарного состояния. В этом предстационарном режиме при использовании большого избытка субстрата  система дифференц. уравнений, описывающая кинетику процессов, линейна. Решение данного типа системы линейных дифференц. уравнений дается суммой экспоненциальных членов. Так, для кинетич. схемы, представленной выше, кинетика накопления продукта имеет вид:
система дифференц. уравнений, описывающая кинетику процессов, линейна. Решение данного типа системы линейных дифференц. уравнений дается суммой экспоненциальных членов. Так, для кинетич. схемы, представленной выше, кинетика накопления продукта имеет вид:
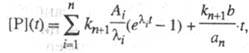
где Ai-, b, аn — функции элементарных констант скорости; 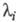 -корни соответствующего характеристич. уравнения.
-корни соответствующего характеристич. уравнения.
Величина, обратная 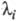 , наз. характеристич. временем процесса:
, наз. характеристич. временем процесса:
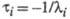
Для реакции, протекающей с участием n промежут. соед., можно получить n характеристич. времен.
Исследование кинетики ферментативной реакции в предстационарном режиме позволяет получить представление о детальном механизме каталитич. цикла и определить константы скорости элементарных стадий процесса.
Экспериментально кинетику ферментативной реакции в предстационарном режиме исследуют с помощью метода остановленной струи (см. струевые кинетические методы), позволяющего смешивать компоненты реакции в течение 1 мс.
Релаксационная кинетика. При быстром возмущающем воздействии на систему (изменение температуры, давления, электрич. поля) время, которое необходимо системе для достижения нового равновесия или стационарного состояния, зависит от скорости процессов, определяющих каталитич. ферментативный цикл.
Система уравнений, описывающая кинетику процесса, линейна, если смещение от положения равновесия невелико. Решение системы приводит к зависимостям концентраций компонентов разл. стадий процесса в виде суммы экспоненциальных членов, показатели экспонент которых имеют характер времен релаксаций. Результатом исследования является спектр времен релаксации, соответствующий числу промежут. соед., участвующих в процессе. Величины времен релаксаций зависят от констант скорости элементарных стадий процессов.
Релаксационные методы кинетики позволяют определить константы скорости отдельных элементарных стадий трансформации интермедиатов. Методы изучения релаксационной кинетики имеют разл. разрешающую способность: поглощение ультразвука — 10−6–10−10 с, температурный скачок — 1O−4–10−6 с, метод электрич. импульса — 10−4–10−6 с, скачок давления — 10−2 с. При исследовании кинетики ферментативных реакций наиб. применение нашел метод температурного скачка.
Макрокинетика ферментативных процессов. Развитие методов получения гетерогенных катализаторов путем иммобилизации ферментов на разл. носителях (см. иммобилизованные ферменты) обусловило необходимость анализа кинетики процессов с учетом массопереноса субстрата. Теоретически и экспериментально исследованы закономерности кинетики реакций с учетом эффектов диффузионного слоя и для систем с внутридиффузионными затруднениями при распределении фермента внутри носителя.
В условиях, когда на кинетику процесса влияет диффузионный перенос субстрата, каталитич. эффективность системы уменьшается. Фактор эффективности 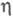 равен отношению плотности потока продукта в условиях протекания ферментативной реакции с диффузионно пониженной концентрацией субстрата к потоку, который мог бы реализоваться в отсутствие диффузионных ограничений. В чисто диффузионной области, когда скорость процесса определяется массопереносом субстрата, фактор эффективности для систем с внешнедиффузи-онным торможением обратно пропорционален диффузионному модулю
равен отношению плотности потока продукта в условиях протекания ферментативной реакции с диффузионно пониженной концентрацией субстрата к потоку, который мог бы реализоваться в отсутствие диффузионных ограничений. В чисто диффузионной области, когда скорость процесса определяется массопереносом субстрата, фактор эффективности для систем с внешнедиффузи-онным торможением обратно пропорционален диффузионному модулю  :
:
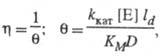
где ld — толщина диффузионного слоя, D — коэф. диффузии субстрата.
Для систем с внутридиффузионным торможением в реакциях первого порядка
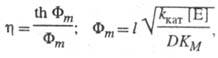
где Фт — безразмерный модуль (модуль Тиле).
При анализе кинетич. закономерностей в ферментативных реакторах широкое теоретич. и эксперим. развитие получили "идеальные" модели реакторов, проточный безградиентный реактор (проточный реактор идеального перемешивания), проточный реактор с идеальным вытеснением, мембранный реактор.
Кинетика полиферментных процессов. В организме (клетке) ферменты действуют не изолированно, а катализируют цепи трансформации молекул. Реакции в полиферментных системах с кинетич. точки зрения можно рассматривать как последоват. процессы, специфич. особенностью которых является катализ ферментами каждой из стадий:
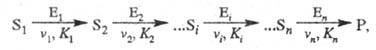
где vi, Ki — соотв. макс. скорость процесса и константа Михаэлиса i-й стадии реакции соответственно.
Важная особенность процесса — возможность образования устойчивого стационарного состояния. Условием-его возникновения может служить неравенство vi > v0, где v0 — скорость лимитирующей стадии, характеризуемой наименьшей константой скорости и тем самым определяющей скорость всего последоват. процесса. В стационарном состоянии концентрации метаболитов после лимитирующей стадии меньше константы Михаэлиса соответствующего фермента.
Специфич. группу полиферментных систем составляют системы, осуществляющие окислительно-восстановит. реакции с участием белковых переносчиков электронов. Переносчики образуют специфич. структуры, комплексы с детерминированной последовательностью переноса электрона. Кинетич. описание такого рода систем рассматривает в качестве независимой переменной состояния цепей с разл. степенью заселенности электронами.
Применение. Ф. р. к. широко используют в исследовательской практике для изучения механизмов действия ферментов и ферментных систем. Практически значимая область науки о ферментах — инженерная энзимология, оперирует понятиями Ф. р. к. для оптимизации биотехнол. процессов.
Лит.: Полторак О. M., Чухрай E. С, Физико-химические основы ферментативного катализа, М., 1971; Березин И.В., Мартинек К, Основы физической химии ферментативного катализа, М., 1977; Варфоломеев С. Д., Зайцев С. В., Кинетические методы в биохимических исследованиях, M.. 1982.
С. Д. Варфоломеев
