урана оксиды
УРАНА ОКСИДЫ
UO2, U3O8, U4O9 и UO3. Д и о к с ид UO2 (минерал ураниниг) — черно-коричневые кристаллы (табл.); при 30,44 К происходит фазовый переход парамагнетик- → антиферромагнетик; начиная с ~ 2000 К наблюдается аномальный рост теплоемкости; температурный коэф. линейного расширения 9,3∙10−6K−1 (293–373 К), 1,08∙10−4K−1 (1173–1273 К); твердость по Моосу 6–7; в воде не раств., не взаимод. с H2, CO, газообразным HCl; с CCl4 в присутствии CS2 при 450 °C образует UCl4; в атмосфере O2 при температуре ниже 250 С образует оксиды состава UO2+x (х = 0–3,34). Получают UO2 восстановлением U3O8 или UO3 водородом при температуре выше 500 °C, термич. разложением UO2C2O4 или (NH4)2[UO2(CO3)3] в восстановит. или инертной атмосфере восстановлением UO2F2 влажным H2. UO2, обогащенный 235U,- ядерное топ-ливо; минерал — исходное вещество в производстве U, UF4 и др. соед. урана.
ХАРАКТЕРИСТИКА ОКСИДОВ УРАНА
таблица в процессе добавления
а 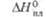 78 кДж/моль;
78 кДж/моль; 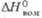 605 кДж/моль (0 К). б Температура разложения. в Угол
605 кДж/моль (0 К). б Температура разложения. в Угол 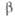 = 99,03°. г Температура начала диссоциации на воздухе;
= 99,03°. г Температура начала диссоциации на воздухе; 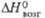 424 кДж/моль (0 К). д Экспериментальная.
424 кДж/моль (0 К). д Экспериментальная.
Октаоксид триурана U3O8 (минерал настуран) — зелено-черные кристаллы; до 210 °C существует α-U3O8 с ромбич. решеткой, выше 210 °C — β-форма с ромбич. решеткой (а = 0,7068 нм, b =1,1445 нм, с = 0,8303 нм, пространственная группа Стст), по др. данным — с гексаген, решеткой; предполагают существование и др. модификаций. U3O8 не раств. в воде; получают его термич. разложением мн. кислородсодержащих соед. U (кроме фосфатов) выше 500 °C или окислением UO2. Октаоксид — осн. компонент урановых хим. концентратов, весовая форма при количеств, определении урана.
При термич. разложении U3O8, начиная с 1500 °C, в равновесии с O2 при атм. давлении находится нанооксид тетраурана U4O9.
Триоксид урана UO3- кристаллич. или аморфное вещество от светло-желтого до оранжевого цвета; существует в след, полиморфных модификациях: α с ромбич. решеткой (а = 0,684 нм, b = 4,345 нм, с = 0,4157 нм), 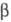 с моноклинной решеткой,
с моноклинной решеткой, 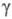 с ромбич. решеткой (а = 0,9813 нм, b = 1,993 нм, с = 0,9711 нм),
с ромбич. решеткой (а = 0,9813 нм, b = 1,993 нм, с = 0,9711 нм), 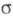 с кубич. решеткой (а = 0,416 нм),
с кубич. решеткой (а = 0,416 нм), 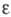 с трикл инной решеткой (а = 0,4002 нм, b = 0,3 841 нм, с = 0,4165 нм, α=98,10°,
с трикл инной решеткой (а = 0,4002 нм, b = 0,3 841 нм, с = 0,4165 нм, α=98,10°, 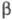 =90,20°,
=90,20°, 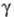 =120,17°) и
=120,17°) и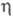 с ромбич. решеткой (а = 0,7511 нм, b = 0,5466 нм, с = 0,5224 нм); на образование той или иной модификации оказывают влияние структура исходного вещества и условия получения. UO3 образует гидраты, разлагается на воздухе при 400 С, восстанавливается H2 выше 500 °C до UO2. Получают его разложением нитрата уранила UO2(NO3)2 при 500 °C, пероксида UO4(H2O)n при 400–500 °C или гидратов при 450 °C. Применяют как компонент пигментов.
с ромбич. решеткой (а = 0,7511 нм, b = 0,5466 нм, с = 0,5224 нм); на образование той или иной модификации оказывают влияние структура исходного вещества и условия получения. UO3 образует гидраты, разлагается на воздухе при 400 С, восстанавливается H2 выше 500 °C до UO2. Получают его разложением нитрата уранила UO2(NO3)2 при 500 °C, пероксида UO4(H2O)n при 400–500 °C или гидратов при 450 °C. Применяют как компонент пигментов.
Прокаливанием У. о. с солями или оксидами щелочных, щел.-зем. или некоторых переходных металлов получают уранаты.
Для У. о. ПДК 0,075 мг/м3.
Б. Ф. Мясоедов
