титана хлориды
ТИТАНА ХЛОРИДЫ
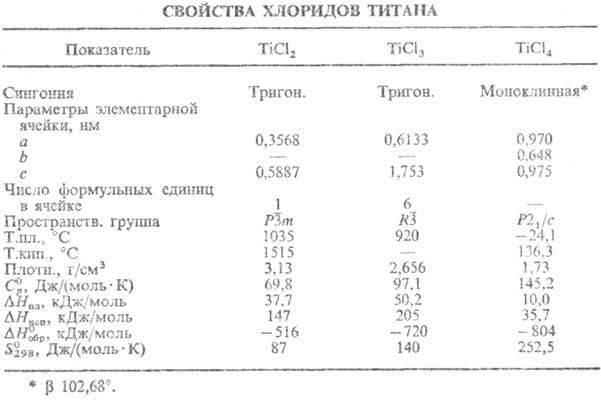
Тетрахлорид TiCl4 — бесцв. прозрачная жидкость, дымящая на воздухе (см. табл.); уравнения температурной зависимости: плотности d= 1,7609--0,00166t — 8,1∙10−7t2 + 1,58∙10−9t3 г/см3 (от −22 до 135 °C), давления пара lgp( мм рт. ст.) = 7,682 — 1964/T(249–409 К); в парах не диссоциирует и не разлагается вплоть до высоких температур; tкрит 365 °C, pкрит 5,01 МПа. Выше 500–600 °C окисляется O2 воздуха до TiO2, в присутствии паров воды образуются также оксихлориды TiOCl2, Ti2O3Cl2. Бурно реагирует с водой с получением TiO2∙nH2O, в качестве промежут. продуктов образуются гидрат TiCl4∙5H2O и гидроксохлориды Ti(OH)nCl4_n∙xH2O. При очень медленном добавлении воды с тщательным перемешиванием и охлаждением можно получить устойчивые конц. растворы TiCl4. Раств. в этаноле и диэтиловом эфире. С парами воды при 300–400 °C дает TiO2. Восстанавливается H2 и активными металлами до TiCl2 и TiCl3, затем-до Ti.
TiCl4 раств. Cl2 (7,6% по массе при 20 °C), незначительно-HCl. Смешивается во всех соотношениях с жидким HCl, а также с хлоридами Sn, С, Si. Раств. в соляной кислоте при пропускании газообразного HCl с получением ярко-желтого раствора гексахлортитановой кислоты H2TiCl6. С разб. H2SO4 образует TiOSO4, с конц. H2SO4-TiCl2SO4.
Получают TiCl4 хлорированием титановых шлаков, ру-тиловых концентратов или др. оксидных материалов в при-сут. восстановителя (кокса) хлором. Процесс ведут либо в шахтных печах при 800–1150 °C, либо в хлораторах с расплавом солей (смесь KCl + NaCl, отработанный расплав производства Mg) при 750–800 °C, либо в печах кипящего слоя при 500–600 °C. Очищают фильтрованием, гидролизом с помощью увлажненного NaCl (удаление As), восстановлением Cu, Al или H2S (удаление V, S, Cr, орг. соед.), дистилляцией и ректификацией. Для получения TiCl4 высокой чистоты используют ректификацию и адсорбцию примесей на силикагеле. Предложена также противоточная кристаллизация в колонне. Используют TiCl4 для получения Ti, TiO2, а также катализаторов (полимеризации этилена и пропилена, алкилирования ароматических углеводородов и др.), как дымообразователь.
TiCl4 поражает слизистые оболочки верх. дыхат. путей и рта, роговицу глаз, вызывает бронхит, ожоги кожи; ПДК 1 мг/м3.
Трихлорид TiCl3-темно-фиолетовые или черные кристаллы; известно неск. политипов, а также коричневая β-мо-дификация (образуется при восстановлении TiCl4 алкилалю-минием), которая после отжига при 250–400 °C превращ. в фиолетовую модификацию; уравнение температурной зависимости давления пара: lgp( мм рт. ст.) = 21,47-9620/T+ + 3,27 lgT (298–800 К); в парах присутствует в основном Ti2Cl6; уже при 440 °C начинает диспропорционировать на TiCl2 и TiCl4. Во влажном воздухе расплывается, быстро окисляется и гидролизуется. Сильный восстановитель. Легко раств. в воде и этаноле с получением фиолетовых растворов; из водных растворов м. б. выделены TiCl3 ∙ 6H2O, а также и тетра-гидрат (зеленого цвета). Водные растворы на свету постепенно окисляются и обесцвечиваются.
Получают TiCl3 восстановлением TiCl4 водородом (при ~ 800 °C), Ti (ок. 600 °C), А1, Si. Используют как компонент катализаторов полимеризации олефинов. Растворы TiCl3 применяют в аналит. химии. ПДК в воде 0,1 мг/л (в пересчете на Ti).
Дихлорид TiCl2-коричневые или черные кристаллы; уравнение температурной зависимости давления пара: lgp (мм рт. ст.) = 9,593 — 10230/Т (753–883 К); уже при 800–850 °C в вакууме диспропорционирует на Ti и TiCl4; сильный восстановитель; на воздухе окисляется, реагирует с водой, выделяя H2, с метанолом и этанолом; плохо раств. в CS2, CHCl3, диэтиловом эфире. Получают восстановлением TiCl4 металлич. Ti, Al, H2 или диспропорцио-нированием TiCl3. Используют при анализе нитро-, нитрозо- и др. орг. соединений.
Т. х. образуют с хлоридами щелочных металлов хлоро-титанаты(II, III, IV), TiCl2 и TiCl3 с KH3-адцукты.
П. И. Федоров
