термодинамика иерархических систем
ТЕРМОДИНАМИКА ИЕРАРХИЧЕСКИХ СИСТЕМ
изучает сложные гетерог. хим. и биол. системы, прежде всего открытые системы, обменивающиеся со средой веществом и энергией. В зависимости от целей и задач исследования протекающие в этих системах процессы могут рассматри-заться как неравновесные или как равновесные (квазиравновесные), а состояние системы-как нестационарное или как стационарное (квазистационарное). Подход Т. и. с. состоит в представлении подобной системы в виде совокупности соподчиненных подсистем, иерархически связанных расположением в пространстве (структурная или пространств. иерархия) и(или) временами установления равновесия при релаксации (временная иерархия).
В каждый момент времени система (или одна из подсистем) м. б. охарактеризована средними удельными (по объему или по массе) функциями состояния, стремящимися к экстремуму при достижении равновесия (обладающими экстремальными свойствами). Изменение состояния системы (подсистемы) во времени (эволюция системы) исследуется по изменениям этих функций. Используется гл. обр. функция Гиббса (энергия Гиббса) G*(p, Т, Хi), где p — давление, Т — температура, Xi-обобщенная сила (любой интенсивный параметр состояния, за исключением давления); для сложной системы G* = U + pV— Xixi — TS, где U — внутр. энергия, V- объем, хi — обобщенная координата (любой экстенсивный параметр состояния, за исключением объема), S-энтропия; величины p, T и Xi являются естественными независимыми переменными функции G*. Для открытой системы полный дифференциал dG* записывается в виде:
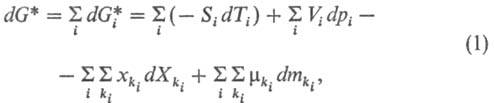
где индекс i обозначает протекающий в системе процесс взаимод. между компонентами (хим. взаимод., межмолекулярное, взаимод. надмолекулярных структур и т. п.), ki-компонент, участвующий в этом процессе, 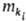 -его масса,
-его масса, 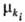 — т. наз. эволюционный потенциал, в широком смысле-движущая сила процесса (см. ниже).
— т. наз. эволюционный потенциал, в широком смысле-движущая сила процесса (см. ниже).
Таким образом, Т. и. с. распространяет подход Гиббса на сложные открытые гетерог. системы и позволяет практически в той же степени опираться на методы вариац. исчисления, что и классич. термодинамика; в принципе у открытых систем не существует термодинамич. функций состояния, характеризующихся экстремальными свойствами. Для описания эволюции иерархич. систем и их подсистем используют методы макрокинетики.
Примером прир. иерархич. системы является биол. популяция pop (сообщество организмов), в которой можно выделить след. подсистемы: организмы org, клетки cel, надмолекулярные образования or, макромолекулы mm, молекулы m и т. д. Все эти подсистемы соподчиненно (иерархически) расположены в пространстве и обладают иерархией времен релаксации ti (характерных времен жизни), а именно эти времена, связанные сильными неравенствами и расположенные в порядке возрастания (или убывания), образуют иерархич. ряд:
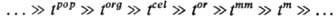
Осн. понятие Т. и. с. — частная эволюция [г'-й процесс в формуле (1)], т. е. агрегация ki-х компонентов системы, участвующих в i-м процессе, на j-м уровне иерархии. В случае закрытой (простой) физ.-хим. системы агрегация структурных элементов-неравновесный самопроизвольный процесс, для которого убыль функции Гиббса можно определить согласно второму началу термодинамики. Так, неравновесную кристаллизацию жидкости ниже температуры плавления можно рассматривать как агрегацию зародышей кристаллизации (верх. иерархич. уровень) в объеме однородной жидкости (ниж. иерархич. уровень). Убыль функции Гиббса системы можно вычислить по приближенному уравнению Гиббса — Гельмгольца ΔG = ΔH(ΔТ/Тпл), где ΔH-изменение энтальпии системы при кристаллизации, ΔT= Тпл — Т> 0 (Тпл — температура плавления вещества, Т — температура кристаллизации переохлажденного вещества). Аналогично можно вычислить убыль функции Гиббса для процессов агрегации структурных элементов при спирализации цепей ДНК, агрегации молекул белков или полисахаридов с образованием надмолекулярных структур, агрегации надмолекулярных образований, клеток и т. д. Сопоставляя, напр., изменения функции Гиббса процессов образования разл. надмолекулярных структур ΔGim, можно судить о термодинамич. стабильности этих структур.
Установлено, что в ходе эволюции живых прир. систем на каждом иерархич. уровне повышается термодинамич. стабильность структурных элементов, составляющих данный уровень. Согласно принципу структурной стабилизации, i-й процесс, протекающий на 7-м структурном уровне, стабилизирует продукты (i-1)-го процесса предыдущего (j — 1)-го (более низкого) иерархич. уровня. Поскольку система является открытой, агрегация j-х структурных элементов накапливает наиб. стабильные (j + 1)-е структуры на данном иерархич. уровне. Например, в некоторых прир. системах накапливаются вещества с повышенной (по абс. величине) функцией Гиббса ΔGim образования определенных надмолекулярных структур (этот эффект в некотором смысле аналогичен накоплению в хроматографич. колонке вещества с повыш. энергией Гиббса адсорбции ΔGa вследствие того, что время удерживания этого вещества tret зависит от ΔGim экспоненциально):
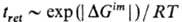
(R-газовая постоянная).
В Т. и. с. вводится представление об эволюц. потенциале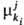 компонента ki, участвующего в i-м процессе на j-м иерархич. уровне. В общем случае
компонента ki, участвующего в i-м процессе на j-м иерархич. уровне. В общем случае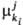 представляет собой изменение соответствующего термодинамич. потенциала при бесконечно малом изменении числа элементов ki-гo типа в частной эволюции (i-й процесс на j-м уровне). Так,
представляет собой изменение соответствующего термодинамич. потенциала при бесконечно малом изменении числа элементов ki-гo типа в частной эволюции (i-й процесс на j-м уровне). Так, 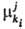 может быть определен через G*:
может быть определен через G*:
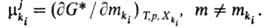
В этом смысле хим. потенциал компонента системы является частным случаем эволюц. потенциала. Эволюц. потенциал позволяет наиб. простым и универсальным способом определять условия равновесия внутри любой подсистемы. Т. и. с. определяет направленность эволюц. процесса как процесса структурообразования (самосборки; см. самоорганизация). Показано, что эволюция прир. систем обусловлена стремлением к экстремальным значениям уд. величин термодинамич. функций (функции Гиббса, функции Гельмгольца и т. п.). Например, при образовании надмолекулярной структуры на 7-м иерархич. уровне вследствие межмолекулярного взаимод. усредненная по объему функция Гиббса биол. системы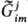 стремится к минимуму. В этом случае
стремится к минимуму. В этом случае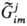 является интегральной величиной, характеризующей нестационарную открытую гетерог. систему:
является интегральной величиной, характеризующей нестационарную открытую гетерог. систему:
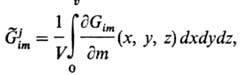
где V — объем системы, т-масса, х, у, z-координаты. В результате взаимод. (агрегации) j-х надмолекулярных образований появляется новая структурно выделенная подсистема, обладающая большим характерным временем жизни, т. е. (j + 1)-й уровень иерархии. Вследствие обмена каждой из подсистем со средой система в целом накапливает наиб. стабильные структуры, т. е. структуры, обладающие повыш. функцией Гиббса образования (агрегации). Эти структуры преим. аккумулируют хим. соединение с повыш. функцией Гиббса образования (повыш. энергоемкостью). Таким образом, в процессе эволюции биол. система обогащается липидами, белками, полисахаридами и т. п. и обедняется водой, что проявляется в изменении ее брутто-состава. Вариации хим. состава живых организмов в онтогенезе и филогенезе имеют термодинамич. природу.
Т. и. с. позволяет анализировать поведение физ.-хим., эко-логич. систем, передачу биол. признаков по наследству.
Основы Т. и. с. сформулированы в 80-х гг. 20 в.
Лит.: Гладышев Г. П., Термодинамика и макрокинетика природных иерархических процессов, М., 1988; Васнецова А. Л., Гладышев Г. П., Экологическая биофизическая химия, М., 1989; Gladyshev G. P., "Journal of Biological Systems", 1993, v. 1, № 2.
Г. П. Гладышев
