тантала оксиды
ТАНТАЛА ОКСИДЫ
Оксид Ta(V) (пентаоксид дитан-тала) Та,О5; до 1360 °C устойчив β-Та2O5- бесцветные кристаллы ромбич. сингонии (а = 0,6198 нм, b = 4,029 нм, с = = 0,3888 нм, z =11), т. пл. 1787 °C, плотн. 8,18 г/см3, C0 134,9 Дж/(моль∙К), 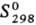 141,9 Дж/(моль∙К); выше 1560 °C устойчив α-Та2O5-серые кристаллы тетрагон, сингонии (а — 0,381 нм, с = 3,609 нм, z = 6, пространственная группа I41/amd), т. пл. 1887 °C, плотн. 8,37 г/см3,
141,9 Дж/(моль∙К); выше 1560 °C устойчив α-Та2O5-серые кристаллы тетрагон, сингонии (а — 0,381 нм, с = 3,609 нм, z = 6, пространственная группа I41/amd), т. пл. 1887 °C, плотн. 8,37 г/см3, 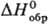 −2047,2 кДж/моль. Обе модификации имеют общие структурные элементы-блоки из октаэдров ТаО6 и искаженных пентагональных бипирамид ТаО7, связанных в трехмерный каркас, но характер сочленения блоков различен. Скорость β
−2047,2 кДж/моль. Обе модификации имеют общие структурные элементы-блоки из октаэдров ТаО6 и искаженных пентагональных бипирамид ТаО7, связанных в трехмерный каркас, но характер сочленения блоков различен. Скорость β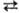 α-перехода (ΔH ~ 2 кДж/моль) мала. β-Ta2O5-полупроводник, ширина запрещенной зоны 1,79 эВ, ρ 105 Ом∙см (1000 К), переход из р-типа в n-тип — при 1300 К и давлении O2 105 Па.
α-перехода (ΔH ~ 2 кДж/моль) мала. β-Ta2O5-полупроводник, ширина запрещенной зоны 1,79 эВ, ρ 105 Ом∙см (1000 К), переход из р-типа в n-тип — при 1300 К и давлении O2 105 Па.
Некоторые примеси (WO3) стабилизируют β-Ta2O5, другие (Sc2O3)-α-Ta2O5 или метастабильные модификации. При очень быстрой закалке от высоких температур получают d-Та2O5 (близкую к β-форме) гексагон. сингонии (а = 0,3874 нм, с — 0,362 нм). Похожая модификация образуется при кристаллизации аморфного Та2O5. Закалкой от температур выше 1360 °C получена триклинная модификация, близкая α-форме (а = О, 3801 нм, b = 0,3785 нм, с = 3,574 нм, α-90,91°, β-90,19°, γ-90°), которая при 317 °C превращается в моноклинную, а затем при 947 °C — в α-форму. Та2O5 сосуществует с твердым раствором кислорода в металле Та(О) с содержанием О 1,5 ат. % при 1100 К, 6 ат. % при 1950 К. Содержание кислорода в эвтектике Та2O5-Та(О) близко к 50 ат. %.
При высоких температурах Та2O5 реагирует с большинством оксидов, образуя сложные оксиды разнообразного состава. Некоторые из них (с большим содержанием Та2O5) иногда принимались за твердые растворы на его основе. Nb2O5 и Та2O5 образуют ограниченные твердые растворы, при высоких температурах устойчив Та2O5 ∙ 2Nb2O5 (с тетрагон. структурой PNb9O20). Та2O5 не реагирует с H2, ок. 1830 °C взаимод. с С, образуя карбиды и оксикарбиды; с водой и кислотами, кроме фтористоводородной, не реагирует. М. б. переведен в растворимые соед. обработкой фтористоводородной кислотой, сплавлением с гидросульфатами, карбонатами, гидроксидами Na и К. В. последнем случае после обработки водой м. б. получен раствор, содержащий ион [Та6О19]8−, из которого этанолом осаждается K8Та6О19∙16H2O, кислотами-аморфный Та2O5∙xH2O, иногда называемый танталовой кислотой, Ta2O5∙xH2O получают также гидролизом TaCl5 или обработкой кислотами продуктов сплавления Та2O5 или танталовых концентратов с карбонатами металлов. Свежеосажденный Та2O5-хH2O легко раств. в растворах HF, KOH. Т. наз. танталаты (NaTaO3, Na3TaO4, Ca2Ta2O7 и др.) обычно являются сложными оксидами, в которых отсутствуют танталат-ионы. Дегидратацией Та2O5∙xH2O при 220 °C получают аморфный Та2O5, при 560 °C-кристаллич. d-Та2O5.
Та2O5-промежут. продукт в производстве Та, танталатов; двойные оксиды Ta(V) и Sr используют как варисторы, Та и Ва- термоэмиссионные материалы (Ва6Та2O11), Та и Ba или Pb-сегнетоэлектрики, Та и Са-катализаторы в орг. синтезе.
Диоксид ТаO2 — бесцветные кристаллы с тетрагон. решеткой типа рутила (а = 0,4709 нм, с = 0,3065 нм, z = 2, пространственная группа P42/mnm); метастабильный промежут. продукт реакции Та2O5 с ТаСxОу при температуре ок. 1630 °C и давлении 7,7 ГПа, стабилизируется примесями. При окислении Та (давление O2 10−3–10−6 Па) образуются пленки ТаО и ТаO2 (2–3 монослоя). Ранее были описаны Та6О, Та4O, Та2O, ТаО, однако за эти фазы ошибочно принимались оксикарбиды и оксинитриды, хотя некоторые из этих Т.о. могут образовываться при распаде пересыщенных твердых растворов Та-О. В газовой фазе найдены только молекулы ТаО и ТаO2.
Лит.: Мирошникова Л. Д. [и др.], "Ж. неорган. химии", 1989,. т. 34, № 1, с. 184–87.
Л. М. Ковба
