сурьмы халькогениды
СУРЬМЫ ХАЛЬКОГЕНИДЫ
соед. Sb с S, Se, Те. Наиб. важны сесквихалькогениды-соед. состава Sb2Х3 (табл. 1)-темно-серые кристаллы, практически нерастворимые в воде, органических растворителях, разлагаются HNO3, царской водкой. С. х. при нагр. в вакууме сублимируются (Sb2S3 и Sb2Se-конгруэнтно, Sb2Те3-инконгруэнтно), состав пара сложен, уравнение температурной зависимости давления пара над С.х.: lgp (мм рт. ст.)= —А/Т+В (значения коэф. А и В см. в табл.2). С. х. — полупроводники, Sb283 и Sb2Se3 имеют высокие значения ρ, фоточувствительны. При нагр. на воздухе окисляются до оксидов халькогенов и Sb. При взаимодействии С.х. с 8ЬНа13 образуются халькогенгалогениды SbXHal, некоторые из них обладают сегнетоэлектрич., фотоэлектрич. и полупроводниковыми свойствами. Наиб. важен SbSI-красные кристаллы; сегнетоэлектрич. фаза SbSI кристаллизуется в ромбич. сингонии (при 6 °C а = 0,852 нм, b = 1,012 нм, с = 0,411 нм, z — 4, пространственная группа Рпа21); температура перехода сегнетоэлектрик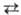 параэлектрик ок. 18–22 °C.
параэлектрик ок. 18–22 °C.
Мн. металлы (напр., Fe) при нагр. вытесняют Sb из Sb2S3. Реакция Sb2S3 с Fe лежит в основе осадит. выплавки Sb из антимонитовых руд. Sb2S3 раств. в растворах сульфидов щелочных металлов с образованием M3SbS3 и др. тиоантимона-тов(III), эта реакция лежит в основе гидрометаллургич. извлечения Sb из антимонита. В растворах полисульфидов М2Sn, где M-NH4, Na, К, n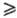 2, сульфид Sb2S3 раств. с образованием M3SbS4, MSbS3.
2, сульфид Sb2S3 раств. с образованием M3SbS4, MSbS3.
Для С.х. характерно образование твердых растворов, напр. Sb2Те3_хSex, SbxBi2-xSe3 и др. Теллурид Sb2Те3-нестехио-метрич. соед.; границы области гомогенности, ат. % Те: 59,2–59,25 (420 °C), 59,4–59,6 (500 °C), 59,45–59,75 (550 °C); вне области гомогенности стехиометрич. состав.
Сульфид Sb2S5-оранжево-красное аморфное вещество (может содержать свободную серу); плотн. 4,12 г/см3; разлагается при нагр. в вакууме выше 120 °C до Sb2S3 и S; практически не раств. в воде, легко раств. в растворах щелочных сульфидов и полисульфидов с образованием тиоантимона-тов(V) MSbS3, M3SbS4, раств. в щелочах. Получен малоустойчивый дисульфид Sb2S4.
Теллурид SbTe — кристаллы темно-серого цвета; имеет область гомогенности в пределах 40,9–53,8 ат. % Те (500–540 °C). Существует также теллурид Sb с широкой областью гомогенности в пределах 17,3–36,9 ат. % Те (500–530 °C) с гексагон. решеткой.
С. х. получают сплавлением простых веществ в вакуумированных запаянных кварцевых ампулах, в промышленности Sb2S3 (техн. назв. "крудум") — зейгерованием (разделение смеси на компоненты в результате различия в их температурах плавления) из антимонитовых штуфных руд или возгонкой в вакууме из флотационных антимонитовых концентратов. Монокристаллы Sb2S3 выращивают осаждением из паровой фазы, монокристаллы Sb2Te3, Sb2Se3-из расплава по методу Бриджмена. Зонную перекристаллизацию используют как для очистки, так и для получения монокристаллов.
Аморфный Sb2S3 (оранжевого цвета) осаждают из солянокислых растворов соед. Sb действием H2S. Сульфид Sb2S5 в промышленности получают обработкой Sb2S3 раствором NaHS или NaOH в присутствии S с послед. разложением тиосолей разб. H2SO4. Лаб. способ-разложение Na3SbS4 соляной кислотой.
С. х. встречаются в природе в виде минералов — антимонита (стибнит, сурьмяный блеск) Sb2S3, метастибнита (аморфный) Sb2S2,9 -Sb2S3, хоробетсуита переменного состава, напр. Sb1,2Bi0,8S3, кермезита Sb2S2O; встречаются также редкий' минерал теллуросурьма (теллурантимон) Sb2Te3, сложные сульфиды, теллуриды, селениды.
Антимонитовые руды-главный источник Sb, их используют также для получения Sb2S3 и др. соед. сурьмы. Sb2S3-компонент головок спичек, рубинового стекла; Sb2S3, Sb2S5-компоненты пиротехн. составов. Sb2S3, Sb2Se3-полупроводниковые материалы в фоторезисторах, фотоэлементах, электроннолучевых приборах. Sb2Te3-компонент материалов для термоэлектрич. генераторов (Bi1_xSbxTe3 и др.); Sb2Se3-легирующая добавка для термоэлектрич. материалов. Sb2S5-пигмент в красках, вулканизующий агент для красной резины; SbSI-сегнетоэлектрик, полупроводниковый материал для фото- и терморезисторов, компонент халькогенидных стекол.
Пыль Sb2S5, Sb2S3 при нагр. на воздухе воспламеняется, КПВ Sb2S3 194 г/м3. Аэрозоли С.х. токсичны; ПДК Sb2S5 2 мг/м3, Sb2S3 1 мг/м3.
Лит.: Полупроводниковые халькогениды и сплавы на их основе, М., 1975, с. 148–81.
И. Н. Один
