серебра галогениды
СЕРЕБРА ГАЛОГЕНИДЫ
фториды состава Ag2F, AgF и AgF2 и др. галогениды состава AgX (см. табл.).
Гемифторид Ag2F при нагр. выше 90 °C и при растворении в воде разлагается с образованием AgF и Ag; диамагнитен; м. б. получен УФ облучением AgF. Фторид AgF гигроскопичен; хорошо раств. в воде (172 г в 100 г при 20 °C); в системе AgF-H2O температура эвтектики −14,2 °C (37,5% по массе AgF); до 18,6 °C в равновесии с раствором (62,9% по массе AgF) находится тетрагидрат AgF∙4H2O (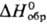 −1387,8 кДж/моль,
−1387,8 кДж/моль, 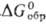 −1145,6 кДж/моль), до 39,5 °C (68,95% AgF)-дигидрат AgF∙2H2O (
−1145,6 кДж/моль), до 39,5 °C (68,95% AgF)-дигидрат AgF∙2H2O (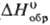 −801,6 кДж/моль,
−801,6 кДж/моль, 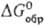 −669,9 кДж/моль), выше 39,5 °C — безводная соль. Дифторид AgF2 разлагается водой с образованием AgF, HF, O2 и примеси O3.
−669,9 кДж/моль), выше 39,5 °C — безводная соль. Дифторид AgF2 разлагается водой с образованием AgF, HF, O2 и примеси O3.
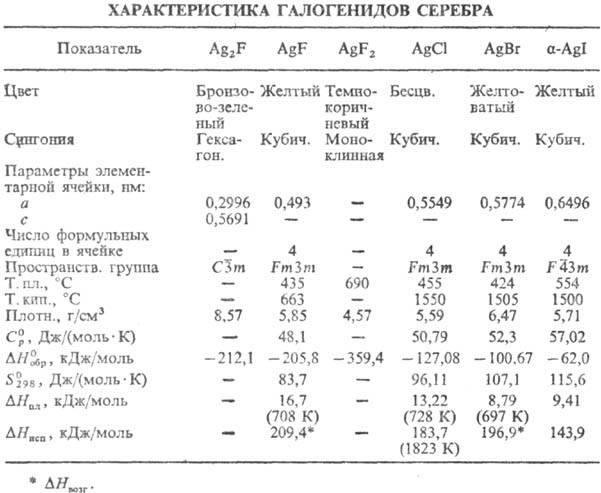
Хлорид (минерал хлораргирит, или кераргирит, роговое серебро) AgCl в газовой фазе находится в виде моно-, ди- и тримерных молекулу не раств. в воде (произведение растворимости 1,8∙10−10), раств. в конц. HNO3.
Бромид (минерал бромаргирит) AgBr до 259 °C существует в кубич. кристаллич. модификации, выше 259 °C — в ромбич.; не раств. в воде (произведение растворимости 5,4∙10−13).
Иодид (минерал иодаргирит) Agl существует в неск. кристаллич. модификациях: до 136 °C устойчив α-Agl, в интервале 136 — 147 °C-гексагон. β-форма (а = 0,4596 нм, с = 0,7500 нм, z = 2, пространственная группа Р63 тс), выше 147 °C — кубич. γ-модификация; не раств. в воде (произведение растворимости 8,5∙10−17), раств. в этаноле.
С. г. раств. в избытке соответствующих галогеноводородных кислот с образованием галогенидных комплексов, они также раств. в растворах цианидов и тиосульфатов щелочных металлов и водном аммиаке с образованием комплексных ионов Ag. С. г. восстанавливаются до Ag неорг. (Pb, Zn, Mg, H2) и орг. (гидразин, формальдегид, гидрохинон и т. п.) восстановителями. Под действием света разлагаются с выделением Ag°; светочувствительность AgF больше, чем у AgCl.
С. г. получают взаимод. Ag с галогенами в присутствии воды, а также обработкой Ag конц. водными растворами галогеново-дородных кислот и обменным взаимод. между растворимой солью Ag и соответствующим галогенидом металла.
Для регенерации Ag из разл. отходов используется сплавление С. г. с карбонатами щелочных металлов. С. г. (AgCl, AgBr, AgI) используют для получения светочувствит. эмульсий в производстве кино- и фотоматериалов. Из AgCl изготовляют элементы оптики для ИК спектрометров, детекторы космич. излучений. AgBr-катализатор при получении некоторых карбоновых кислот. AgF, AgI и двойные иодиды щелочных металлов и Ag обладают высокой ионной проводимостью в твердом состоянии и применяются для изготовления твердых электролитов и датчиков. AgF используют также как компонент люминофоров и фторирующий агент в орг. синтезе, AgI — при гальванич. серебрении, для образования искуссю дождя и снега из грозовых туч.
П. М. Чукуров
Значения в других словарях
- Серебра галогениды — Химические соединения серебра с галогенами. Хорошо изучены галогениды одновалентного серебра: фторид — AgF, хлорид — AgCI, бромид — AgBr, иодид — Agl. Известны также Ag2F и AgF2 (сильный окислитель). Большая советская энциклопедия
