свинца сульфаты
СВИНЦА СУЛЬФАТЫ
Сульфат свинца(II) PbSO4 — бесцветные кристаллы; до 878 °C существует α-PbSO4 с ромбич. решеткой (а = 0,8480 нм, b = 0,5938 нм, с — 0,6958 нм, z = 4, пространственная группа Рпта), выше 878 °C-моноклинная форма p-PbSO4; ΔH полиморфного перехода 17,0 кДж/моль; т. пл. 1170 °C, выше температуры плавления разлагается с образованием SO2, O2, оксисульфатов Pb и затем PbO; плотн. 6,35 г/см3; 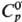 103,29 Дж/(моль∙К);
103,29 Дж/(моль∙К); 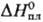 40,2 кДж/моль,
40,2 кДж/моль, 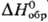 −921,20 кДж/моль;
−921,20 кДж/моль; 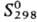 148,71 Дж/(моль∙К); показатели преломления: больший Ng 1,8937, средний Nm 1,8826, меньший Np 1,8771. Растворимость (г в 100 г): в воде-0,0045 (25 °C), 0,0057 (50 °C); в растворе 5% H2O-95% H2SO4-0,080 (25 °C). Раств. в водных растворах ацетата и тартрата NH4, щелочей, горячей H2SO4, не раств. в этаноле. Углем и H2 восстанавливается до PbS. Реагирует с PbS с образованием Pb и SO2, эта реакция (наряду с другими) протекает при выплавке Pb из сульфидных руд. Образует основные сульфаты (3PbO ∙ PbSO4 ∙ H2O, PbO ∙ PbSO4 и др.), двойные сульфаты [K2Pb(SO4)2 и др.]. В природе встречается минерал англезит α-PbSO4.
148,71 Дж/(моль∙К); показатели преломления: больший Ng 1,8937, средний Nm 1,8826, меньший Np 1,8771. Растворимость (г в 100 г): в воде-0,0045 (25 °C), 0,0057 (50 °C); в растворе 5% H2O-95% H2SO4-0,080 (25 °C). Раств. в водных растворах ацетата и тартрата NH4, щелочей, горячей H2SO4, не раств. в этаноле. Углем и H2 восстанавливается до PbS. Реагирует с PbS с образованием Pb и SO2, эта реакция (наряду с другими) протекает при выплавке Pb из сульфидных руд. Образует основные сульфаты (3PbO ∙ PbSO4 ∙ H2O, PbO ∙ PbSO4 и др.), двойные сульфаты [K2Pb(SO4)2 и др.]. В природе встречается минерал англезит α-PbSO4.
Получают PbSO4 осаждением из растворов солей Pb(II) ионами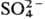 , окислением PbS, напр. H2O2. Применяют PbSO4 для заполнения ячеек пластин в свинцовых аккумуляторах, как компонент лаков и пигментов; PbO ∙ PbSO4 и 3PbOx xPbSO4∙H2O-добавки к цинковым и свинцовым белилам (для повышения устойчивости покрытий). Известен гидросульфат Pb(HSO4)2,
, окислением PbS, напр. H2O2. Применяют PbSO4 для заполнения ячеек пластин в свинцовых аккумуляторах, как компонент лаков и пигментов; PbO ∙ PbSO4 и 3PbOx xPbSO4∙H2O-добавки к цинковым и свинцовым белилам (для повышения устойчивости покрытий). Известен гидросульфат Pb(HSO4)2, 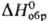 −1825,1 кДж/моль.
−1825,1 кДж/моль.
Сульфат свинца(IV) Pb(SO4)2-желтоватые кристаллы; разлагается при нагр.; гидролизуется водой с образованием Pb(OH)2SO4 и затем PbO2∙xH2O; плохо раств. в горячей конц. H2SO4; образует двойные сульфаты M2Pb(SO4)3; сильный окислитель; получают в виде осадка при электролизе 80%-ной H2SO4 со свинцовыми электродами.
С.с. токсичны; ПДК 0,01 мг/м3 (в пересчете на Pb).
И. Н. Один
