протеогликаны
ПРОТЕОГЛИКАНЫ
углевод-белковые компоненты животных тканей, в которых полисахаридные цепи ковалентно связаны с белком, занимающим в молекуле центр. положение. В отличие от гликопротеинов, углеводные цепи в молекулах П. всегда представлены мукополисахаридами (хонд-роитинсульфатами, дерматансульфатом, кератансульфатом, гепарансульфатом и гепарином).

В молекулах всех П., кроме протеокератансульфата, углеводные цепи присоединены к гидроксильным группам остатков L-серина полипептидной цепи через специфич. олигосахаридную группировку, не встречающуюся в др. углевод-белковых соед. (см. табл.). Напротив, протеокератан-сульфаты сходны в этом отношении с гликопротеинами, поскольку их углеводные цепи являются продолжением либо N-связанных олигосахаридных фрагментов гликопротеинов (протеокератансульфат роговицы), либо О-связанных олигосахаридных цепей муцинового типа (протеокератансульфат хряща).
Белковая часть молекул П. может иметь упрощенный аминокислотный состав. Так, в белковых цепях протеогепаринов преобладает чередование остатков серина и глицина. В других П. наряду с аналогичными участками, несущими углеводные цепи, имеются домены с более разнообразным аминокислотным составом, с помощью которых осуществляется комплексообразование с др. биополимерами или закрепление П. в клеточной мембране. Примеры полного установления аминокислотной последовательности белковой части П. вследствие серьезных эксперим. трудностей пока немногочисленны.
Разные П. могут существенно отличаться размером белковой части молекулы, а также числом, природой и расположением углеводных цепей. В состав макромолекулы П могут одновременно входить гликозаминогликоновые цепи неск. типов, а также О- и N-олигосахаридные фрагменты, характерные для гликопротеинов. Многообразие П. затрудняет создание четкой классификации и номенклатуры этих соединений. Обычно указывают тип ткани, из которой получен П., общий размер молекулы (условно различают "большие" и "малые" П.), преобладающую структуру углеводных цепей (возможны гибридные формы) и способность к специфич. взаимодействиям с гиалуроновой кислотой ("агрегирующие" и "неагрегирующие" П.) Строение молекул различных П показаны на рисунке
Выделение П из прир объектов включает солюбилиза-цию тканей в 4 М растворе хлорида гуанидиния, послед. центрифугирование в градиенте плотности или выделение с использованием ионообменной хроматографии. Для установления строения П проводят разделение углеводной и белковой частей молекулы с помощью восстановит. расщепления под действием оснований в присут NaBH4 (для О-гликозидов серина и треонина), ферментативного гидролиза эндогли-козидазами или действием жидкого HF Освобожденную от углеводов пептидную часть молекулы характеризуют физ.-хим. или иммунологич. методами и определяют аминокислотную последовательность Альтернативный подход определение нуклеотидной последовательности участка ДНК, кодирующего биосинтез белковой части П. Для определения углеводной части П используется набор методов хим. (кислотный гидролиз, периодатное окисление, де-заминирование с использованием HNO2) и ферментативного расщепления на олигосахариды, а также спектроскопия ЯМР
Наиб. количества П. содержатся в соединит ткани животных, где эти вещества, в первую очередь протеохондроитинсульфаты и протеодерматансульфаты, в комплексе с гиалуроновой кислотой, коллагеном и некоторыми др. белками обеспечивают необходимые физ.-мех. свойства таких образований, как кости, сухожилия, хрящи, межпозвоночные диски, кожа, стенки кровеносных сосудов, роговица, стекловидное тело глаза и др.
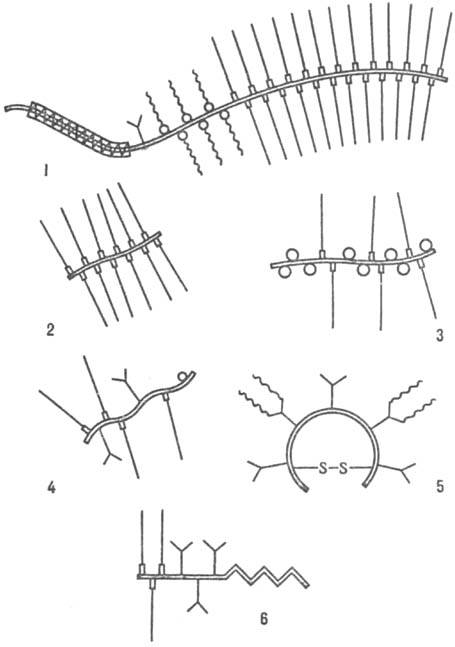
Схематич. изображение структур протеогликанов: 1 — протеогликан хряща, 2 — протеогепарин; 3 — протеодерматансульфат с олигосахаридами муцинового типа, 4 — протеохондроитинсульфат или протеодерматансульфат небольшой мол. массы, 5 — протеокератансульфат роговицы; 6 — протеогепарансульфат клеточной поверхности. условные обозначения: = пептидная цепь,  гидрофобный участок полипептидной цепи,
гидрофобный участок полипептидной цепи,  участок связывания с гиалуронатом,
участок связывания с гиалуронатом,  N-связанные олигосахариды, О О-связанные олигосахариды муцинового типа, D участок связи с белком GlcA—Gal2—Xyl—Ser —гликозаминогликуронановые цепи,
N-связанные олигосахариды, О О-связанные олигосахариды муцинового типа, D участок связи с белком GlcA—Gal2—Xyl—Ser —гликозаминогликуронановые цепи,  цепи кератансульфата.
цепи кератансульфата.
Протеогепарансульфаты-компоненты клеточной поверхности во мн. типах тканей и участвуют в обеспечении специфич. клеточной адгезии и защите клеток от повреждения при инфекциях. Протеогепарин синтезируется и накапливается в специализир. ("тучных") клетках, продукты его ферментативного расщепления являются прир. регуляторами процесса свертывания крови (антикоагулянтами). Для многих П отмечены отчетливые возрастные изменения. Известны многочисл. нарушения биосинтеза или катаболизма П., с которыми непосредственно связан ряд тяжелых заболеваний (нарушения зрения, функций костно-суставного аппарата, воспалит артриты, атеросклероз и др.).
Лит.: The biochemistry of glycoproteins and proteoglycans, ed. by W J. Lennarz, N Y L., 1980; Biology of proteoglycans. ed. by Т N. Wight, R.P Mecham, San Diego [a.o.], 1987.
А. И. Усов
