пиррол
ПИРРОЛ
мол. м. 67,09; бесцветная жидкость с запахом хлороформа, медленно темнеет при стоянии на воздухе; т. кип. 130 °C,т. пл. −23,4 °C; 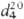 0,9698;
0,9698; 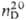 1,5086; μ 5,17∙10−30 Кл∙м (чистое вещество), 6,00∙10−30 Кл∙м (раствор в бензоле, циклогексане);
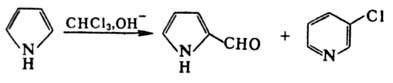
1,5086; μ 5,17∙10−30 Кл∙м (чистое вещество), 6,00∙10−30 Кл∙м (раствор в бензоле, циклогексане); 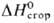 −2364,2 кДж/моль. Гигроскопичен, смешивается во всех отношениях с большинством орг. растворителей, плохо раств. в воде (6 г в 100 г воды при 25 °C). Молекула П. плоская, полярная, направление диполя — от атома N внутрь кольца. П. — гетероароматич. соед.; ароматич. система образована 2 парами электронов от двойных связей и неподеленной парой электронов атома N (π-избыточный гетероцикл). П.-NH-кислота (рKа 17,5, вода). При обработке Na или К или их амидами в жидком NH3, а также реакцией с металлом в инертном растворителе получают Na- и К-соли П., которые алкилируются и ацилируются по атому N. Литиевую соль получают взаимодействием П. с Li в жидком NH3 или с бутил- или фениллитием в эфирном растворе. N-Замещенные П. металлируются бутил- или фениллитием в положение 2. С реактивами Гриньяра в эфире П. легко образует N-пирролмагниевые производные, которые алкилируются и ацилируются по атому С-2. Для П. характерны реакции электроф. замещения, которые преим. идут по α-углеродным атомам. Протонирование П. минеральными кислотами приводит к нарушению ароматичности системы и вызывает полимеризацию (образуется т. наз. пиррол-красный). Нитрование П. ацетилнитратом приводит к 2-нитропирролу с примесью 3-нитропроизводного; сульфирование комплексом пиридин-SO3 при 100 °C — к образованию пиррол-2-сульфо-кислоты. При реакции П. с галогенами очень легко образуется тетрагалогенпиррол. Активные алкилгалогениды (аллил- и бензилгалогениды) в присутствии слабых оснований алкилируют П. в положения 2 и 5, CH3I при 100–150 °C-также и в положения 3 и 4. Ацилирование П. уксусным ангидридом при 100 °C приводит к смеси 2-ацетил- и 2,5-диацетилпирролов. Наличие в положении 1 электроноакцепторной фенилсульфонильной группы изменяет ориентацию электроф. замещения: ацилирование 1-фенилсульфонилпиррола по Фриде-лю-Крафтсу селективно идет по положению 3. Под действием HCN, HCl и POCl3 в ДМФА или CHCl3 в щелочной среде П. форматируется с образованием 2-формил-пиррола. При использовании CHCl3 из-за образования дихлоркарбена идет побочная реакция с образованием 3-хлорпиридина:
−2364,2 кДж/моль. Гигроскопичен, смешивается во всех отношениях с большинством орг. растворителей, плохо раств. в воде (6 г в 100 г воды при 25 °C). Молекула П. плоская, полярная, направление диполя — от атома N внутрь кольца. П. — гетероароматич. соед.; ароматич. система образована 2 парами электронов от двойных связей и неподеленной парой электронов атома N (π-избыточный гетероцикл). П.-NH-кислота (рKа 17,5, вода). При обработке Na или К или их амидами в жидком NH3, а также реакцией с металлом в инертном растворителе получают Na- и К-соли П., которые алкилируются и ацилируются по атому N. Литиевую соль получают взаимодействием П. с Li в жидком NH3 или с бутил- или фениллитием в эфирном растворе. N-Замещенные П. металлируются бутил- или фениллитием в положение 2. С реактивами Гриньяра в эфире П. легко образует N-пирролмагниевые производные, которые алкилируются и ацилируются по атому С-2. Для П. характерны реакции электроф. замещения, которые преим. идут по α-углеродным атомам. Протонирование П. минеральными кислотами приводит к нарушению ароматичности системы и вызывает полимеризацию (образуется т. наз. пиррол-красный). Нитрование П. ацетилнитратом приводит к 2-нитропирролу с примесью 3-нитропроизводного; сульфирование комплексом пиридин-SO3 при 100 °C — к образованию пиррол-2-сульфо-кислоты. При реакции П. с галогенами очень легко образуется тетрагалогенпиррол. Активные алкилгалогениды (аллил- и бензилгалогениды) в присутствии слабых оснований алкилируют П. в положения 2 и 5, CH3I при 100–150 °C-также и в положения 3 и 4. Ацилирование П. уксусным ангидридом при 100 °C приводит к смеси 2-ацетил- и 2,5-диацетилпирролов. Наличие в положении 1 электроноакцепторной фенилсульфонильной группы изменяет ориентацию электроф. замещения: ацилирование 1-фенилсульфонилпиррола по Фриде-лю-Крафтсу селективно идет по положению 3. Под действием HCN, HCl и POCl3 в ДМФА или CHCl3 в щелочной среде П. форматируется с образованием 2-формил-пиррола. При использовании CHCl3 из-за образования дихлоркарбена идет побочная реакция с образованием 3-хлорпиридина:
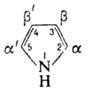
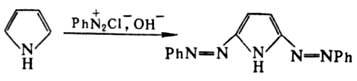
По реакции Манниха П. превращ. в 2-диалкиламинометил-пирролы. С активир. алкенами (эфиры акриловой кислоты, акрилонитрил, малеиновый ангидрид и др.) в присутствии кислот или оснований П. вступает в реакцию, подобную реакции Михаэля, с образованием продуктов алкилирования в положения 2 и 5. При нагр. с водным раствором (NH4)2CO3 под давлением П. карбоксилируется до аммониевой соли пиррол-2-карбоновой кислоты. В нейтральной или слабокислой среде вступает в реакцию азосочетания с образованием 2-азопроизводного, в щелочных средах дает бис-азопроизводное, напр.:
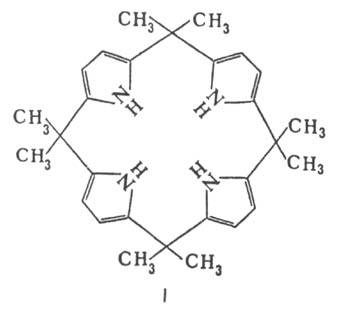
С ацетоном в кислой среде П. образует циклич. тетрамер формулы I.
При умеренных температуре и давлении П. легко гидрируется в пирролидин (кат. — Pt, Pd, Ni-Ренея). При восстановлении с помощью Zn и HCl м. б. выделен 3-пирролин. Воздухом на свету П. окисляется в имид янтарной кислоты, хромовой кислотой — в малеинимид.
В солянокислом растворе n-диметиламинобензальдегида (реактив Эрлиха) П. дает красную окраску, с SeO2 в водном растворе — фиолетовую, с изатином образует синий осадок. Идентифицируют П. обычно в виде комплекса с HgCl2 (т. пл. 143 °C).
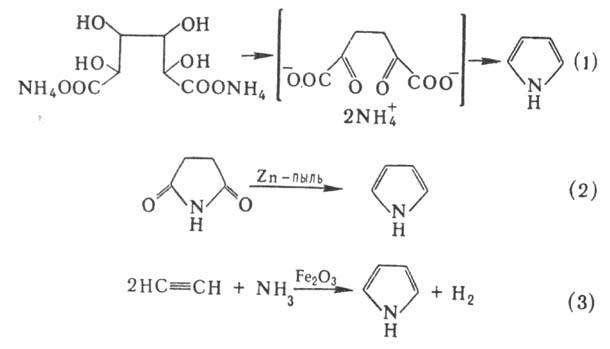
Получают П. перегонкой аммониевой соли слизевой кислоты (вариант синтеза Пааля-Кнорра, реакция 1), перегонкой ими-да янтарной кислоты с цинковой пылью (2), пропусканием ацетилена и NH3 через прокаленную трубку в присутствии оксидов Fe (III) или Pb (3), каталитич. аммонолизом фурана или тиофена в присутствии Al2O3 (реакция Юрьева):
П. содержится в кам.-уг. смоле. Цикл П. — структурный фрагмент прир. пигментов (напр., тема, хлорофиллов, желчи, витамина B12, некоторых антибиотиков), а также некоторых светостойких фталоцианиновых красителей.
П. умеренно токсичен; его пары вызывают стойкое и упорное повышение температуры тела; ЛД50 74 мг/кг (кролики, перорально).
П. используют для синтеза пирролидина и некоторых лекарственных средств. Он впервые был открыт Ф. Ф. Рунге в 1834 в кам.-уг. смоле; в чистом виде получен T. Андерсоном в 1858 при сухой перегонке рогов и копыт.
Лит.: Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 332–88; Gossauer A., Die Chemie der Pyrrole, В., 1974; J ones R. А., Be a n G. P., The chemistry of pyrroles, N. Y.-L., 1977; Anderson H. J., Loader C. E., "Synthesis", 1985, N 4, p. 353–64.
М. А. Юровская
Значения в других словарях
- Пиррол — Гетероциклическое соединение, бесцветная жидкость, быстро темнеющая на воздухе; tnл — 23,42 °С, tкип 130 °C, плотность 0,9698 г/см3 (20°C), умеренно растворима в воде. П. — очень слабая кислота; с калием или безводным едким кали образует соль. Большая советская энциклопедия
- пиррол — орф. пиррол, -а Орфографический словарь Лопатина
- ПИРРОЛ — ПИРРОЛ (С4Н5N), гетероциклическое органическое химическое СОЕДИНЕНИЕ, состоящее из пятичленного кольца с четырьмя атомами УГЛЕРОДА и одним атомом азота. Научно-технический словарь
- пиррол — [гр. огнецветный + лат. ol(eum) масло] – хим. органическое соединение, бесцветная жидкость с запахом хлороформа, продукт перегонки костяного масла (окрашивает в красный цвет сосновую лучинку, смоченную в соляной кислоте); находит применение при получении различных органических соединений Большой словарь иностранных слов
- Пиррол — C4H5N. — Это соединение впервые открыл в 1834 г. в продуктах перегонки костяного масла Рунге. Название свое П. получил от греческого слова. Энциклопедический словарь Брокгауза и Ефрона
- ПИРРОЛ — ПИРРОЛ — бесцветная жидкость, tкип 130 °С. Содержится в каменноугольной смоле. Ядро пиррола — структурный фрагмент природных пигментов (гема, хлорофиллов) и витамина В12. Большой энциклопедический словарь
