пиримидиновые основания
ПИРИМИДИНОВЫЕ ОСНОВАНИЯ
производные пиримидина, входящие в состав нуклеиновых кислот, нуклео-тидов, коферментов и др. Канонич. П. о. — цитозин (4-амино-2-пиримидон, сокращенно С), тимин (3-метил-пиримидин-2,4-дион, T) и урацил (пиримидин-2,4-дион, U); разл. формы молекул. П. о. (они существуют при разных значениях pH) показаны на схеме.
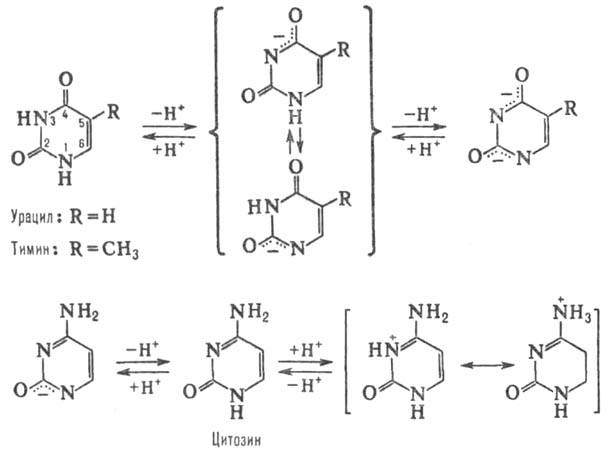
Кроме канонических П. о. в состав нуклеиновых кислот входят т. наз. минорные П. о. (см. минорные нуклеозиды), гл. обр. замещенные по атому С-5-5-метил- и 5-гидроксиметилцитозин, 5-карбоксиметилурацил, а также 5,6-дигидро-урацил, N4-метилцитозин и др.
Специфич. наборы водородных связей между пирими-диновыми и пуриновыми основаниями в комплементарных участках цепей (см. комплементарность), а также межплоскостные взаимод. между соседними основаниями в цепи определяют формирование и стабилизацию вторичной и третичной структуры нуклеиновых кислот. Последовательность пуриновых и пиримидиновых оснований в полинуклеотидной цепи определяет генетич. информацию ДНК и матричных РНК. Модификация П. о. в полинуклеотидах под воздействием мутагенов может приводить к изменению информац. смысла (точковой мутации).
П. о. представляют собой высокоплавкие (т. пл.  300 °C) бесцв. кристаллич. соед., умеренно раств. в горячей воде, не раств. в этаноле и диэтиловом эфире. Существуют в таутомерных формах (константы таутомерного равновесия
300 °C) бесцв. кристаллич. соед., умеренно раств. в горячей воде, не раств. в этаноле и диэтиловом эфире. Существуют в таутомерных формах (константы таутомерного равновесия  105), напр.:
105), напр.:
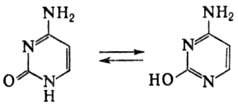
Протонирование и депротонирование П. о. сопровождается изменениями характерных УФ спектров (см. табл.) и реакционной способности.
НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА ПИРИМИДИНОВЫХ ОСНОВАНИЙ
таблица в процессе добавления
Наиб. характерные реакции П. о. с нуклеофилами — присоединение по связи C=C (гидросульфита, гидроксиламина, галогена и др.) и замещение экзоциклич. аминогруппы цитозина (напр., реакции с гидроксиламинами, гидразинами). Последняя реакция значительно облегчается при насыщении связи C=C. Восстановление двойной связи C=C легко осуществляется путем каталитич. гидрирования или действием NaBH4 при УФ облучении. Атом H у С-5 легко замещается на гидрокси- или аминометильную группу, галоген. При действии P2S5 один или оба атома О в урациле и тимине могут замещаться на атом S. При действии на цитозин HNO2 происходит его дезаминирование с образованием урацила.
Реакции П. о. с электроф. реагентами (наиб. изучено алкилирование) идут преим. по атомам N-1 и N-3, в меньшей степени — по экзоциклич. аминогруппе цитозина. В щелочной среде идет также алкилирование по атомам О. Довольно легко протекает ацилирование аминогруппы цитозина.
При радиолизе водных растворов П. о. образуются 5,6-дигидрокси-, 5-гидрокси-6-гидроперокси- и 5-гидроперокси-6-гидрокси-5,6-дигидропиримидины и продукты их дальнейших превращений. Действие УФ излучения (λ > 200 нм) на водные растворы П. о. приводит к образованию 5,6-дигидро-6-гидроксипиримидинов (фотогидратов), циклобутановых димеров (через триплетное состояние) с раскрытием связей C=C, нециклобутановых димеров П. о. (через нижнее синглетное возбужденное состояние). Фотогидраты спонтанно превращ. в исходные соед., а циклобутановые димеры дедимеризуются фотохимически.
Различие реакц. способности П. о. позволяет избирательно модифицировать их в составе полинуклеотидов. Такие реакции лежат в основе определения нуклеотидной последовательности (первичной структуры) нуклеиновых кислот. Взаимод. с соседними основаниями, зависящие от локальной высшей структуры полинуклеотидов, оказывают влияние на скорость модификации П. о. при действии разл. агентов. В связи с этим сопоставление относит. скоростей модификации П. о. используется для изучения вторичной и третичной структуры нуклеиновых кислот.
Как канонические, так и минорные П. о. обычно получают препаративно из нуклеиновых кислот путем кислотного гидролиза и послед. разделения.
Лит.: Кочетков H. К. [и др.], Органическая химия нуклеиновых кислот, М., 1970; Бородавкин А. В. [и др.], Электронная структура, УФ-спектры поглощения и реакционная способность компонентов нуклеиновых кислот, в сб.: Итоги науки и техники, сер. Молекулярная биология, т. 14, М., 1977; Шаба-ров а 3. А., Богданов А. А., Химия нуклеиновых кислот и их компонентов, М., 1978; Photochemistry and photobiology of nucleic acids, v. 1 (Chemistry), ed. by Shi Yi Wang. N. Y., 1976.
Э. И. Будовский
Значения в других словарях
- Пиримидиновые основания — Пиримидины, группа природных соединений, производных гетероциклического азотистого основания Пиримидина. Играют важнейшую роль в жизнедеятельности организмов, входя в состав нуклеиновых кислот. В последних найдены П. Большая советская энциклопедия
- пиримидиновые основания — ПИРИМИДИНОВЫЕ ОСНОВАНИЯ, органич. соединения, производные пиримидина, различающиеся заместителями в пиримиднновом кольце. К ним относятся урацил (I), тимин (II), цитознн (III), 5-метилцитозин (IV) и 5-оксиметилцито-зин (V). П. о. входят в состав нуклеотидов и нуклеиновых кислот. Ветеринарный энциклопедический словарь
- пиримидиновые основания — Группа природных соединений (цитозин, урацил, тимин, а также минорные П. о.), производных гетероциклич. Азотистого основания пиримидина. Биологический энциклопедический словарь
- Пиримидиновые основания — Общее название производных пиримидина (например, цитозин, урацил, тимин); входят в состав нуклеиновых кислот, коферментов и других биологически активных веществ. Медицинская энциклопедия
- ПИРИМИДИНОВЫЕ ОСНОВАНИЯ — ПИРИМИДИНОВЫЕ ОСНОВАНИЯ — природные органические соединения, производные пиримидина. Биологическая роль в жизнедеятельности всех организмов обусловлена участием пиримидиновых оснований в построении нуклеиновых кислот, коферментов и других биологически активных соединений. Большой энциклопедический словарь
